
| A. | 此时,v (A):v (B):v (C):v (D)=4:3:2:1 | |
| B. | 该反应体系中气体的平均相对分子质量不变不可作为平衡标志 | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | C的平均反应速率为:0.15mol/(L•min) |
分析 经2min达平衡状态,此时B反应消耗了0.9mol,则
4A(s)+3B(g)?2C(g)+D(g),
开始 m n 0 0
转化 1.2 0.9 0.6 0.3
平衡 m-1.2 n-0.9 0.6 0.3
A.A为固体,不能表示反应速率,速率之比等于化学计量数之比;
B.气体的物质的量不变,但气体的质量为变量;
C.充入N2使压强增大,若密闭容器的体积不变,则各组分的浓度不变;
D.结合v=$\frac{△c}{△t}$计算.
解答 解:A.v (B):v (C):v (D)=3:2:1,A为固体,不能表示反应速率,故A错误;
B.气体的物质的量不变,但气体的质量为变量,则气体的平均相对分子质量不变,可作为平衡标志,故B错误;
C.充入N2使压强增大,若密闭容器的体积不变,则各组分的浓度不变,则反应速率不变,故C错误;
D.经2min达平衡状态,此时B反应消耗了0.9mol,则生成0.6molC,C的平均反应速率为$\frac{\frac{0.6mol}{2L}}{2min}$=0.15mol/(L•min),故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握速率计算、平衡标志、A为固体为解答的关键,侧重分析与计算能力的考查,注意选项C为易错点,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:推断题
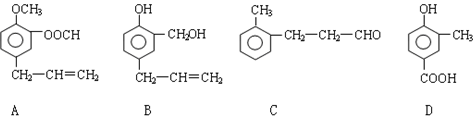
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,变石灰水浑浊 | 该溶液中一定含有CO32- |
| C | 向无色溶液中滴加氯水,再加CCl4振荡、静置、溶液分层,下层呈紫红色 | 该溶液中一定含有I- |
| D | 取洁净的铂丝在酒精灯火焰上灼烧至无色,再蘸取少量溶液置于火焰上灼烧,火焰呈黄色,通过蓝色钴玻璃观察,火焰呈紫色 | 该溶液一定含有Na+、K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
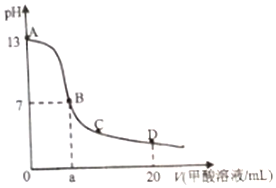 在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )| A. | 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 | |
| B. | 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+) | |
| C. | 在D点:c(HCOO-)+c(HCOOH)>2c(K+) | |
| D. | B→C段:水的电离程度先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
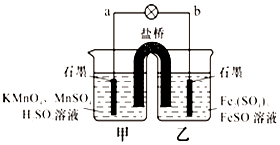 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠粒投入100mL稀盐酸中,溶液质量减轻 | |
| B. | 加热氧化钠和过氧化钠固体混合物,固体质量减轻 | |
| C. | 铁钉放入氯化铜溶液中,固体质量增大 | |
| D. | 光照新制氯水,溶液的颜色变浅,酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
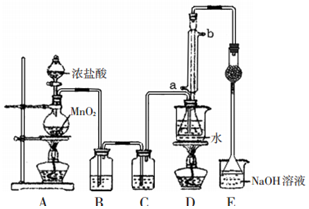 S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).| 物质 | 沸点/℃ | 熔点/℃ |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com