
【化学——选修化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝
 (3)阳极氧化能使金属表面生成
(3)阳极氧化能使金属表面生成
致密的氧化膜。以稀硫酸为电解液,铝
阳极发生的电极反应式为
__________________________________。
(4)在铝阳极氧化过程中,需要不断
地调整电压,理由是____________ ___
。
(5)下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
科目:高中化学 来源: 题型:
(Ⅰ)根据反应4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O回答下列问题:
MnCl2+Cl2↑+2H2O回答下列问题:
(1)氧化剂是 , 氧化产物是 。
(2)HCl(浓)的作用是 。
(3)当有4mol HCl被氧化时,氧化产物的物质的量为 ,反应中转移的电子数为 。
(Ⅱ)丹砂的成分是HgS,汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
反应Ⅰ:HgS+O2  Hg+SO2
Hg+SO2
反应Ⅱ:4HgS+4CaO  4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
(1)反应Ⅰ中,还原产物是________,每生成1molSO2分子,转移电子数为________。
(2)反应Ⅱ中,HgS是________(填“氧化剂”、“还原剂”),用双线桥法标出反应Ⅱ中电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是( )
 A.若A为Fe,D为氢气,则B一定为酸
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 === NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)=== NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)=== NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。

|
结合上述资料回答:
① 开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
② 为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因 是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有50ml0.1mol/L碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,则下列叙述错误的是
A.该反应中H2O是反应物之一 B.氧化剂与还原剂的物质的量之比为1∶5
C.氧化产物为HIO3 D.若有1 mol I2参加氧化反应,转移10 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1 L 1.0 mol/L的NH4Al(SO4)2溶液中含有的氧原子数为8NA
B.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
D.1 mol FeCl3完全水解得到的Fe(OH)3胶体中含有的胶粒的数目为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析错误的是
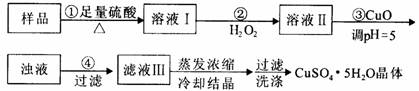
A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=Fe3++2H2O
C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次
D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年1月美国《科学》杂志报道,美国科学家制造出了世界上波长最短、单色纯度的第一束原子X射线激光,他们通过强大的X射线激光,从位于密封舱中的氖原子内层中敲除电子,内层形成空轨道。当其他电子再回落填补那些位置时,大约有1/50的原子通过发出一束X射线回应。这些X射线接着又激发临近的氖原子,随之产生了更多的X射线,如此的多米诺效应将原始X射线激光放大了2亿倍。理解这段话,判断下列说法正确的是( )
A.敲除氖原子内层电子,则这种氖原子的质量数不变
B.缺电子原子结合电子变为中性原子的过程放出能量
C.比氖原子的原子序数小3的元素形成的氢化物中可能既含极性键又含非极性键
D.敲除内层电子的氖原子结构示意图为
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有下列试剂的洗气瓶 ( )
A.澄清石灰水,浓H2SO4 B.酸性KMnO4溶液,浓H2SO4
C.溴水,烧碱溶液,浓H2SO4 D.浓H2SO4,酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com