
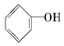
 >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )| A. |  +HCl→ +HCl→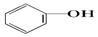 +NaCl +NaCl | B. | 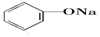 +H2O+CO2→ +H2O+CO2→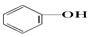 +NaHCO3 +NaHCO3 | ||
| C. | 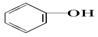 +Na2CO3→ +Na2CO3→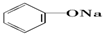 +NaHCO3 +NaHCO3 | D. | 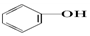 +NaHCO3→ +NaHCO3→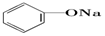 +H2CO3 +H2CO3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
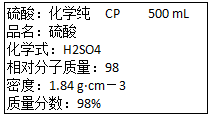 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
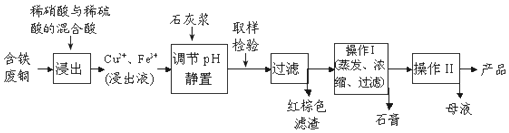
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、CO32- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Mg2+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
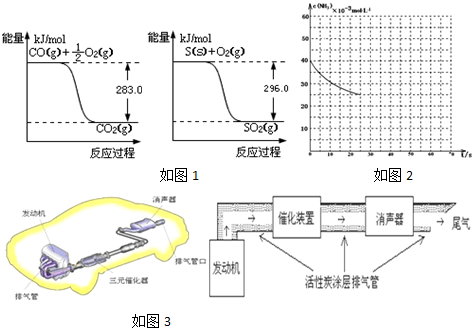
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com