
 碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:
碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:分析 由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁;
(2)根据淀粉遇碘变蓝色判断;
(3)25℃时已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显酸性,说明高碘酸为弱酸,NaIO4溶液中高碘酸根离子水解显碱性;
(4)测定产品中NaI含量,滴加硝酸银,根据硝酸银的物质的量可确定质量分数,注意仪器的使用方法;
(5)依据溶度积常数计算混合溶液中c( I-).
解答 解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,反应的离子方程式为:2Fe+IO3-+3H2O=2Fe(OH)3↓+I-;
故答案为:2Fe+IO3-+3H2O=2Fe(OH)3↓+I-;
(2)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应;
(3)25℃时已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显酸性,说明高碘酸溶液中存在电离平衡,说明高碘酸为弱酸,NaIO4溶液中高碘酸根离子为弱酸阴离子水解显碱性,
故答案为:碱性;
(4)①配制溶液用250mL容量瓶,滴定用酸式滴定管,都应检查是否漏液;
故答案为:250 mL容量瓶、酸式滴定管;
②n(NaI)=n(AgNO3)=0.1mol/L×0.019L=0.0019mol,
则3.000g样品中含有n(NaI)=0.019mol,m(NaI)=0.019mol×150g/mol=2.85g,
ω(NaI)=$\frac{2.85}{3}$×100%=95.00%,
故答案为:95.00%;
(5)已知Ksp(AgI)=1.5×10-16,将AgNO3和NaI的溶液混合,假设混合溶液中AgNO3的浓度为0.01mol•L-1,Ksp(AgI)=c(Ag+)c(I-)=1.5×10-16,
则开始生成AgI沉淀时,混合溶液中c( I-)=$\frac{1.5×1{0}^{-16}}{0.01}$mol/L=1.5×10-14 mol/L,
故答案为:1.5×10-14.
点评 本题考查物质制备实验,明确制备流程中发生的反应及操作为解答的关键,涉及氧化还原反应及碘的特性,注重基础知识的考查,题目难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钡和稀硫酸 BaCO3+2H+=Ba2++H2O+CO2↑ | |
| B. | Ba(OH)2溶液中加入CuSO4溶液:Ba2++SO42-=BaSO4↓ | |
| C. | 硫酸溶液中加入Ba(OH)2溶液:H++OH-═H2O | |
| D. | 澄清石灰水跟盐酸H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 苯与液溴制取溴苯
苯与液溴制取溴苯 反应类型:取代反应
反应类型:取代反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置. ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.
,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为 453.2g | |
| B. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) | |
| C. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为40% | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
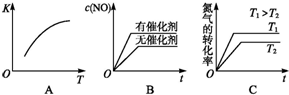 汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com