

| LiAIH4 |
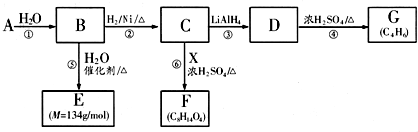
 ,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2.结合有机物的结构和性质以及题目要求可解答该题.
,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2.结合有机物的结构和性质以及题目要求可解答该题. ,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2,
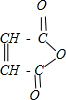
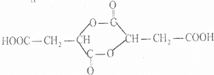
,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2, ,不含氧的官能团为碳碳双键,B的结构简式为HOOCCH=CHCOOH,E的结构简式为:HOOCCH2CH(OH)COOH,可知B生成C的反应为加成反应,由以上分析可知G为CH2=CHCH=CH2,与Br2的CCl4溶液反应,可生成CH2BrCHBrCH=CH2、CH2BrCH=CHCH2Br、CH2BrCHBrCHBrCH2Br3种同分异构体,
,不含氧的官能团为碳碳双键,B的结构简式为HOOCCH=CHCOOH,E的结构简式为:HOOCCH2CH(OH)COOH,可知B生成C的反应为加成反应,由以上分析可知G为CH2=CHCH=CH2,与Br2的CCl4溶液反应,可生成CH2BrCHBrCH=CH2、CH2BrCH=CHCH2Br、CH2BrCHBrCHBrCH2Br3种同分异构体,| Ni |
| △ |
| Ni |
| △ |
 ;
; ,
, ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
 ,
, .
.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
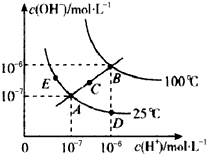
| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
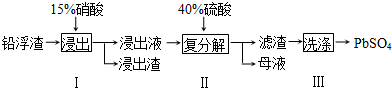
查看答案和解析>>
科目:高中化学 来源: 题型:
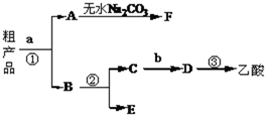 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、800℃下,该反应的化学平衡常数为0.25 |
| B、427℃时该反应的平衡常数为9.4,则该反应的△H>0 |
| C、800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D、800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com