
 ,
,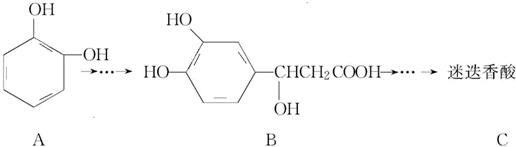
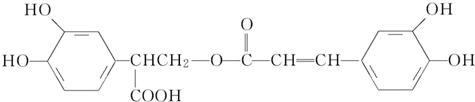
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
分析 A.B中含有苯环、酚羟基、醇羟基和羧基,具有苯、酚、醇和羧酸的性质;
B.苯环为平面结构,与苯环直接相连的原子一定在同一平面内;
C.有机物C在稀硫酸催化下水解,只有酯基断裂;
D.B中酚-OH和-COOH具有酸性.
解答 解:A.B中含有苯环、酚羟基、醇羟基和羧基,具有苯、酚、醇和羧酸的性质,能发生取代反应、加成反应、消去反应、氧化反应、还原反应等,故A正确;
B.苯环为平面结构,与苯环直接相连的原子一定在同一平面内,-OH上的H不一定在同一平面内,故B错误;
C.有机物C在稀硫酸催化下水解,只有酯基断裂,水解产物为 ,没有B物质,故C错误;
,没有B物质,故C错误;
D.B中酚-OH和-COOH具有酸性,则1molB中含2mol酚-OH和1mol-COOH,与足量的NaOH溶液反应,最多可消耗3 molNaOH,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,明确物质结构和性质关系是解本题关键,侧重考查酚、醇、羧酸的性质,易错选项是C,注意其水解产物判断.


科目:高中化学 来源: 题型:多选题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
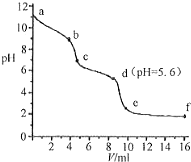 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )| A. | a点时,溶液呈碱性的原因是CO32-发生水解反应,其离子方程式为:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有气体放出 | |
| C. | c点以后,盐酸过量 | |
| D. | d点溶液中c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
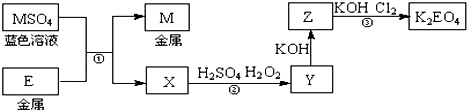
 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是离子化合物,在固态时可以导电 | |
| B. | 工业上也可用电解熔融氧化钙的方法制备金属钙 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能实现⑥的转化 | |
| D. | 工业上以氯气和石灰乳为原料通过反应制造主要成分为CaCl2的漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 | |
| B. | 在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制检验醛基的试剂 | |
| C. | 用托盘天平准确称取14.80g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 | |
| D. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=+1468 kJ•mol-1 | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铁与铝的混合物与足量稀硫酸反应时,转移电子数是3NA | |
| B. | 18g重水(D2O)含有的电子数为9NA | |
| C. | pH=2的醋酸加水稀释到10倍后,溶液中H+数目大于0.001NA | |
| D. | 标准状况下,NA个CH3OH分子的体积约是22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com