
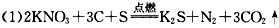
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:阅读理解
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省许昌市五校高二下学期第一次联考化学试卷(带解析) 题型:填空题
下表是A、B、X、Y、Z五种有机物的有关信息:
| A |  B B | X | Y | Z | |||
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:
③能与水在一定条件下反应生成X | ①由C、H两种元素组成; ②球棍模型为: 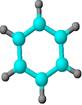 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与Z反应生成相对分子质量为100的酯。 | ①相对分子质量比X少2; ②能由X氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: 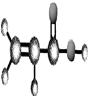 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省高一下学期期中考试化学试卷 题型:实验题
(15分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)虚线框内的实验装置图,所加试剂为 ,说明装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,
化学反应方程式是 ,
该反应属于四种基本反应类型中的 反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因。
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由。
。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
 K2S+N2↑+3CO2↑____________________________
K2S+N2↑+3CO2↑____________________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com