
(6分)Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2?NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
(1)Zn(或锌) 正极 (2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 B
(3)2H++2e-===H2↑ 87
【解析】
试题分析:(1)在Zn?MnO2干电池中负极材料是Zn(或锌);正极材料是石墨。在电池工作时,电子由负极Zn流向正极C。(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,是因为锌与还原出的铜构成铜锌原电池,Zn作负极,从而加快锌的腐蚀速率。欲除去Cu2+,但是又不与其中的其它物质发生反应,也不产生杂质,则应该加入Zn.因此选项为B。(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。在阴极由于阳离子的放电能力H+>Mn2+,所以阴极的电极反应式是2H++2e-===H2↑;若电解电路中通过2 mol电子,则根据质量守恒定律及电子守恒的规律可得1mol的MnO2,质量为87g.
考点:考查原电池、电解池的工作原理、及相应的计算的知识。


科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)有机物A易溶于水,且1 mol A能跟Na反应生成0.5 mol H2,但不与NaOH反应,
已知A通过如下转化关系制得分子式为C4H8O2的酯E,且当D→E时,相对分子质量增加28,B是一种烃。
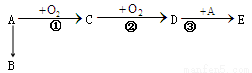
(1)写出A、B的名称和C、D 中官能团的名称
A________ B________ C_______ D ________
E物质的核磁共振氢谱有____________个峰。
(2) ①反应的条件是_________________________;
②反应的化学方程式为___________________________________________。
(3)B与HCl加成可以得到F,F也可以由A与HCl发生__________反应得到。
①由F生成A的条件为________________________。
②由F生成B的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.Si、P、S、Cl 相应的氧化物对应水化物的酸性依次增强
D.在元素周期表中,各主族元素的最高化合价与其族序数相等
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:填空题
(本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤 | 操作 | 现象 |
Ⅰ | 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,其中Fe3+ →Fe2+ ;请写出Fe3+ 跟SO32-反应的离子方程式
______________。
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤 | 操作 | 现象 |
Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤 | 操作 | 现象 |
Ⅲ | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.用AgNO3溶液鉴别NaCl和Na2SO4
B.除去苯中少量苯酚,向混合物中加入足量的NaOH溶液后过滤
C.将碘水和CCl4倒入分液漏斗,振荡后静置,可将碘萃取到CCl4中
D.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—  2CO32— + 6H2O,则下列说法错误的是 ( )
2CO32— + 6H2O,则下列说法错误的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
常温下,0.1 mol/L某一元酸(HA)溶液中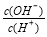 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:填空题
(10分)Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各组反应(表内物质均为反应物)刚开始时,放出H2速率最大的是
编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
A | Al | 0.1 mol | 18.4 mol/L H2SO4 | 10 mL | 60 ℃ |
B | Mg | 0.1 mol | 3 mol/L HCl | 10 mL | 30 ℃ |
C | Fe | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com