
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水.当生成1mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2mol B.1 mol C.0.5mol D.0.25mol
科目:高中化学 来源:2017届黑龙江省大庆市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
在2L密闭容器中通入amolX气体并发生反应:2X(g) Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
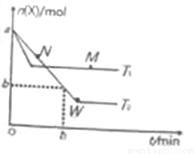
A.正反应方向为放热反应
B.在T2温度下,在0~t1时间内,v(Y)=
C.M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D.W点时再加入一定量X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上学期9月月考化学试卷(解析版) 题型:实验题
实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为2.0g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 __0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为 _______mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上学期9月月考化学试卷(解析版) 题型:选择题
关于下列诗句或谚语,说法不正确的是 ( )
A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
B.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
C.“滴水石穿,绳锯木断”不包含化学变化
D.“落汤螃蟹着红袍”肯定发生了化学变化
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是( )
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能发生加成反应,乙烷不能发生加成反应
C.甲苯能使酸性高锰酸钾溶液褪色,乙烷、苯不能使酸性高锰酸钾溶液褪色
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的
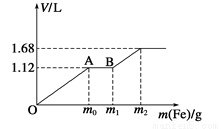
A.开始时产生的气体为H2
B.AB段产生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5mol·L-1
D.参加反应铁粉的总质量m2=5.6 g
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三第一次诊断性考试化学试卷(解析版) 题型:填空题
氢气是一种清洁能源,又是合成氨工业的重要原料。
(1)已知:CH4(g)+H2O==CO+3H2(g) △H=206.2 kJ·mol-1。
CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=247.4 kJ·mol-1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为___________________。
(2)工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测 得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(NH3)=__________mol·L-1·min-1,该温度下该反应的平衡常数K=________。 欲增大氮气的平衡转化率,可采取的措施有_____________、____________等(共写两条措施即可,每空一条)。
(3)下图所示装置工作时均与H2有关。
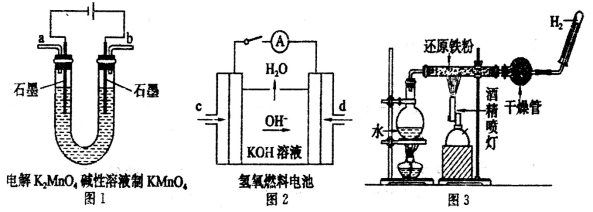
图l所示装置中阳极的电极反应式为______________。
②图2所示装置中,通入H2的管口是_____________(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后.将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液。溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论_____________(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明)______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com