
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省甘谷一中高三第四次检测化学试卷(带解析) 题型:单选题
向100mL pH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
| A.0.02mol | B.0.08mol | C.0.10mol | D.0.16mol |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省南山中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是 。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH= 。
(4)常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+) c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为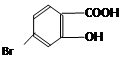 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。
查看答案和解析>>
科目:高中化学 来源:2013届河南省高二第二次月考化学试卷(解析版) 题型:填空题
(7分)
(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
|
序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
12 |
|
② |
22.00 |
18.00 |
11 |
|
③ |
22.00 |
22.00 |
7 |
x = ____________ ;Ba(OH)2溶液的物质的量浓度为____
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH ______7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com