
分析 (1)根据浓度对化学平衡移动的影响知识来回答;
(2)乳酸显示酸性,可以代替氢离子,根据信息:HbO2还可以吸附CO2和氢离子方程下:HbO2+H++CO2?Hb(H+)CO2+O2来回答;
(3)人体在肌肉剧烈运动时会产生乳酸[CH3CH(OH)COOH]和CO2,放出大量的热量,根据(2)进行回答.
解答 解:(1)HbCO的形成使得血红蛋白不再携带氧气而造成人员中毒,一旦发生CO中毒,首要做的事是让患者呼吸新鲜的空气,呼吸新鲜空气,增加氧气浓度,降低一氧化碳的浓度;故答案为:呼吸新鲜空气,增加氧气浓度,降低一氧化碳的浓度;
(2)HbO2还可以吸附CO2和氢离子方程下:HbO2+H++CO2?Hb(H+)CO2+O2,乳酸显示酸性,可以代替氢离子,乳酸在血液中和氧合血红蛋白发生的化学方程式为HbO2+CH3CH (OH)COOH+CO2、Hb(H+)CO2+O2+CH3CH(OH)COO-,故答案为:HbO2+CH3CH (OH)COOH+CO2、Hb(H+)CO2+O2+CH3CH(OH)COO-;
(3)人体在肌肉剧烈运动时会产生乳酸[CH3CH(OH)COOH]和CO2,放出大量的热量,乳酸在血液中和氧合血红蛋白发生的化学方程式为HbO2+CH3CH (OH)COOH+CO2、Hb(H+)CO2+O2+CH3CH(OH)COO-,所以乳酸和氧合血红蛋白的反应是吸热反应,升温时平衡右移.
故答案为:吸热;因为升温时平衡右移.
点评 本题考查化学平衡移动原理的应用知识,题目难度中等,该题中注意知识的熟练应用.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.
A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
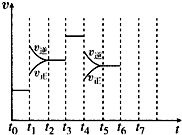 在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③⑧⑦⑥⑤④ | B. | ②①③⑥⑦⑧⑤④ | C. | ①②③⑧⑦⑥④⑤ | D. | ②①⑧③⑦⑥④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m=2 | |
| B. | 达平衡时,Z的体积分数为10% | |
| C. | 达平衡后,保持容器体积不变,加热,容器内压强将增大 | |
| D. | 将平衡后的容器体积压缩至1L,X的浓度为0.45mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com