
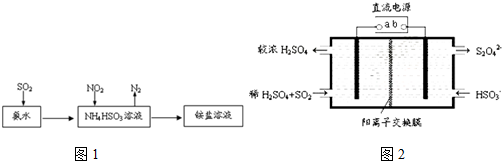
分析 (1)依据CO和NO2通过催化转化器将其转化为无污染的两种气体是氮气和二氧化碳进行解答;
(2)已知:
N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1 ①
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1 ②
将②-①可得:C(s)+2NO(g)=CO2(g)+N2(g),据此计算;
(3)根据图示可知,二氧化硫溶于氨水后得到的HSO3-与二氧化氮发生氧化还原反应,据此写出离子方程式;
(4)①b极上HSO3-得电子生成S2O42-;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应生成氮气;
(5)先根据H2O温度由18℃升至62.4℃利用公式 Q=m•c(t2-t1)求出10g硫磺燃烧共放出热量,然后求出1mol(32g)硫磺燃烧放出的热量,从而得到燃烧热的热化学方程式.
解答 解:(1)CO和NO2通过催化转化器将其转化为无污染的两种气体是氮气和二氧化碳,反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
(2)已知:
N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1 ①
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1 ②
将②-①可得:C(s)+2NO(g)=CO2(g)+N2(g)△H=-393.5kJ•mol-1-180.6kJ•mol-1=-574.1KJ/mol;
故答案为:-574.1;
(3)氨水可以将SO2和NO2同时吸收处理,二氧化硫与氨水反应生成亚硫酸氢根离子,NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+,
故答案为:2NO2+4HSO3-=N2+4SO42-+4H+;
(4)①依据图示可知,阴极上HSO3-得电子生成S2O42-,阴极区发生反应2HSO3-+2H++2e-=S2O42-+2H2O;
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,
故答案为:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O;
(5)10g硫磺燃烧共放出热量为:Q=m•c(t2-t1)=500g×4.18×10-3 kJ•(g•℃)-1×(62.4-18)℃=92.8 kJ,
则1mol(32g)硫磺燃烧放出的热量为:92.8kJ×32/10=297 kJ,所以硫磺的燃烧热为 297 kJ•mol-1,
热化学方程式为S(s)+O2(g)=SO2(g)△H=-297 kJ•mol-1,
故答案为:S(s)+O2(g)=SO2(g)△H=-297 kJ•mol-1.
点评 本题考查盖斯定律的应用、氮的氧化物的性质以及电解原理的分析应用等,题目比较综合,题目难度中等,明确盖斯定律的应用方法和电解池电极方程式的书写方法是解题的关键,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 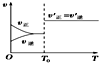 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 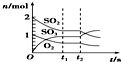 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
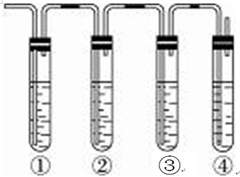 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②⑤⑥⑧ | C. | ②③⑥⑧ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
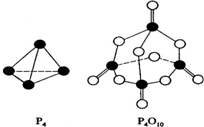 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活注重节能减排,减少温室气体的排放 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能由大到小的顺序为O>N>C | |
| B. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| C. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为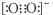 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △S>0 | |
| B. | 产物CO 为酸性氧化物 | |
| C. | 高温条件下才能自发进行 | |
| D. | 采用碎沙而非石块的原因可能是加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com