
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
分析 A.未冷藏储运,温度升高,蛋白质发生变性;
B.碳的氧化物与酸雨无关;
C.从沙滩到用户”,可知沙子的成分为二氧化硅,为光纤的材料;
D.明矾不具有强氧化性.
解答 解:A.未冷藏储运,温度升高,蛋白质发生变性,则应冷藏储运,故A正确;
B.碳的氧化物与酸雨无关,与S、N的氧化物有关,故B错误;
C.从沙滩到用户”,可知沙子的成分为二氧化硅,为光纤的材料,计算机芯片的主要成分为Si,故C错误;
D.明矾不具有强氧化性,不能杀菌消毒,故D错误;
故选A.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
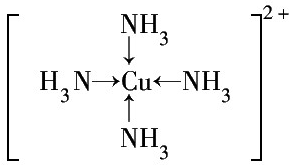 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
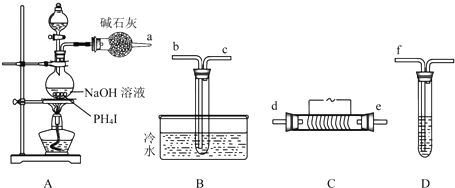
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>① | |
| B. | 一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1-10-5)mol/L | |
| D. | 现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
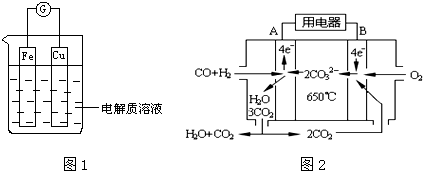
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
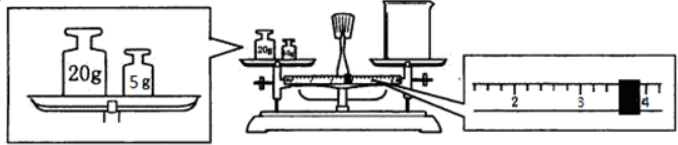
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com