
下列微粒中,其核外电子数相同

A.①②③ B.②③④ C.①②④ D.①③④
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市雨花区高一下学期期末考试化学试卷(解析版) 题型:填空题
(12分)I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为 。
(2)下列物质中,不可以通过乙烯加成反应得到的是 (填序号)。
A.CH3CH3B.CH3CHCl2
C.CH3CH2OHD.CH3CH2Br
(3)已知 2CH3CHO+O2 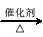 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
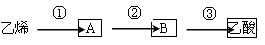
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是 。
II. 在实验室可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇、乙酸分子中官能团的名称分别是 、 。
(2)试管a中发生反应的化学方程式为 ,反应类型是 。
(3)浓H2SO4的作用是: 。
(4)反应开始前,试管b中盛放的溶液是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市雨花区高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各分子中所有原子都满足最外层为8电子结构的是
A.BeCl2 B. PCl3 C. PCl5 D.H2S
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市雨花区高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.凡含碳元素的化合物都是有机化合物
B.烃是指仅含碳和氢两种元素的有机物
C.烃是指燃烧后生成二氧化碳和水的有机物
D.所有的有机物均难溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏宿迁市高一下学期期末测试化学试卷(解析版) 题型:实验题
(12分)完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:

(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、
(写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014江苏宿迁市高一下学期期末测试化学试卷(解析版) 题型:选择题
漆酚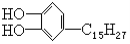 是我国特产漆的主要成分,漆酚不应具有的化学性质是
是我国特产漆的主要成分,漆酚不应具有的化学性质是
A.可以跟FeCl3溶液发生显色反应
B.可以使酸性KMnO4溶液褪色
C.可以跟Na2CO3溶液反应放出CO2
D.可以跟溴水发生取代和加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广西贵港市毕业班5月高考冲刺模拟理综化学试卷(解析版) 题型:实验题
(15分)实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
步骤一:废铜屑制硝酸铜
如图,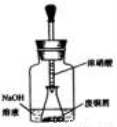
用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是 ,
用该装置制取硝酸铜,好处是 。
(2)步骤二中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外);洗涤的目的是 。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→ Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为 g,化学式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:简答题
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。

(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X
B.M、X、Z三种元素形成的单质熔点:X>M>Z
C.Y、Z两种元素的含氧酸酸性:Z>Y
D.Y、Z两种元素的单核阴离子还原性:Y>Z
(3)元素W与M按原子个数比1:l形成的化合物的电子式为 。
(4)元素X与Z形成的五原子分子的空间结构属于 形。
(5)与Z同族的元素都能与氢元素形成氢化物,其中水溶液酸性最弱的是 (填化学式)。
(6)含有N元素的两种离子在溶液中相遇能快速发生反应,写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com