
【题目】过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒、禽流感病毒)、细菌、真菌及芽孢。下面是市售过氧乙酸商品标签:

有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH)。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
①提出假设:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
②实验验证:取甲、乙两种溶液少许,分别加入几滴_________试液,若①中假设正确,则甲溶液的现象为_____________________,乙溶液的现象为__________。
(2)有关过氧乙酸的叙述正确的是_________ (填编号)
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用可增强消毒效果
C.过氧乙酸与乙酸属于同系物
D.氧元素的化合价为-2价
(3)实验室制备少量过氧乙酸,可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
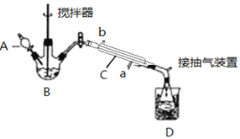
请回答下列问题:
①仪器C的名称是_______________;
②为更好地控制反应温度,应采用方法是_________________;
③生成过氧乙酸的化学方程式为________________________________________;
④碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL 10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mL Na2S2O3标准液。该样品中过氧乙酸的物质的量浓度是_____mol/L。(结果保留小数点后两位)(提示:CH3COOOH+2I+2H+ =I2+CH3COOH +H2O)
【答案】甲H2O2、H2O、H2SO4 乙CH3COOH 、 H2O 石蕊 甲:溶液先变红后褪色 乙:溶液由无色变为红色 A 冷凝管(或直形冷凝管) 水浴加热 CH3COOH + H2O2→CH3COOOH + H2O 7.15
【解析】
(1)若假设甲溶液的有效成分是H2O2,则乙溶液的有效成分是CH3COOOH,根据过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),H2O2是极弱的电解质,在酸性介质中才能稳定存在,则H2SO4应该在甲溶液中,另外两种溶液中的水也是一种主要成分;两溶液都呈酸性,都能使紫色石蕊试液变红,但是甲溶液中H2O2漂白作用的会使变红的溶液褪色;
(2)结合选项对过氧乙酸(CH3COOOH)性质判断,
(3)①由仪器的结构,可知C为直形冷凝管;
②控制B中混合液的温度为20~30℃,应采取水浴加热;
③结合题中信息,写出生成过氧乙酸的化学反应方程式;
CH3COOOH+2I+2H+ =I2+CH3COOH +H2O,2Na2S2O3+I2=Na2S4O6+2NaI,由这两个方程式,确定关系式:CH3COOOH~I2~2Na2S2O3,计算稀释后5.00mL溶液中过氧乙酸的物质的量,再计算原来的2.00mL溶液中的过氧乙酸的物质的量,再根据物质的量浓度定义式计算。
(1)若假设甲溶液的有效成分是H2O2,则乙溶液的有效成分是CH3COOOH,根据过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),H2O2是极弱的电解质,在酸性介质中才能稳定存在,则H2SO4应该在甲溶液中,另外两种溶液中的水更是一种主要成分;两溶液都呈酸性,都能使紫色石蕊试液变红,但是甲溶液中H2O2漂白作用的会使变红的溶液褪色;
(2)过氧乙酸与羟基乙酸(HOCH2COOH)的分子式都是C2H4O3,但结构不同,故互为同分异构体;过氧乙酸具有强氧化性,而苯酚易被氧化,两者混合发生氧化还原反应,不能增强消毒效果;过氧乙酸的分子结构中存在过氧根而乙酸中没有,两者结构不相似,不属于同系物;过氧乙酸中的氧元素有+2价、+1价;
(3)①由仪器的结构,可知C为直形冷凝管;
②控制B中混合液的温度为20~30℃,应采取水浴加热,受热均匀,便于控制温度;
③乙酸与过氧化氢在浓硫酸、20~30℃条件下反应生成过氧乙酸(CH3COOOH),反应的化学方程式为:CH3COOH + H2O2![]() CH3COOOH + H2O ;
CH3COOOH + H2O ;
④CH3COOOH+2I+2H+ =I2+CH3COOH +H2O,2Na2S2O3+I2=Na2S4O6+2NaI,由这两个方程式,确定关系式:CH3COOOH~I2~2Na2S2O3,可知稀释后的5.00mL溶液中过氧乙酸的物质的量是:![]() ×0.0143L×0.1000mol/L,原来2.00mL溶液中的过氧乙酸的物质的量是:
×0.0143L×0.1000mol/L,原来2.00mL溶液中的过氧乙酸的物质的量是:![]() ×0.0143L×0.1000mol/L×
×0.0143L×0.1000mol/L×![]() =0.0143mol,该该样品中过氧乙酸的物质的量浓度是:
=0.0143mol,该该样品中过氧乙酸的物质的量浓度是:![]() =7.15 mol/L 。
=7.15 mol/L 。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知![]() ,则
,则![]() 的燃烧热为
的燃烧热为![]()
B.已知甲烷氧化:![]() ,则反应物的键能总和大于生成物的键能总和
,则反应物的键能总和大于生成物的键能总和
C.已知![]() ,则将
,则将![]() 和
和![]() 置于一密闭容器中充分反应后放出
置于一密闭容器中充分反应后放出![]() 的热量
的热量
D.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则该反应的热化学方程式为:
的热量,则该反应的热化学方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为___,该元素的符号是___;
(2)Y元素原子的价层电子的电子排布图为___,该元素的名称是___;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为___;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)可利用甲烷与水蒸气重整反应制得。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-242kJmol-1
O2(g)=H2O(g) △H1=-242kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJmol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802.6KJmo1-1
则甲烷和水蒸气重整反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
(2)重整反应中CH4的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图1所示。
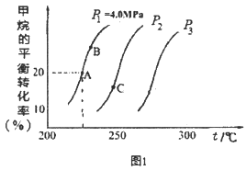
①图中A点的平衡常数KP=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),比较A、B、C三点的平衡常数Kp(A)、KP(B)、KP(C)由大到小的顺序为___。
②图中压强P1、P2、P3由大到小的顺序为___,理由是____。
(3)在恒容密闭容器中充入2mol的CH4和H2O(曲混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图2所示。请比较a、b两点CH4的转化率a点___b点(填“>”、“<”、“=”下同),a点c(CH4)___b点c[H2O(g)]。当x=1时,下列叙述正确的是____(填序号)。
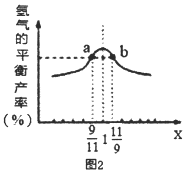
A.平衡常数K最大 B.CH4的转化率最大
C.氢气的产率最大 D.合成气的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________

(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产、生活与化学息息相关,下列说法不正确的是![]()
![]()
A.将铝制品置于电解液中作为阳极,用电化学氧化的方法,可以在铝制品表面生成坚硬的氧化膜。
B.防治酸雨的措施可以对煤燃烧后形成的烟气脱硫,目前主要用石灰法。
C.压敏胶黏剂(即时贴)只需轻轻一压就能黏结牢固,其黏附力为分子间作用力。
D.人体所需六大营养物质:糖类、油脂、蛋白质、维生素、无机盐和水,其中产能最高的是糖类。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,可用于摄影和蓝色印刷,110℃失去结晶水,230℃分解。某化学研究小组对K3[Fe(C2O4)3]3H2O受热分解生成的气体产物和固体产物进行探究。
实验一:探究实验所得的气体产物,按如图装置进行实验(夹持仪器已略去,部分装置可重复使用)。

(1)实验室常用饱和NH4Cl和饱和NaNO2的混合液制N2,反应的化学方程式为__。
(2)装置的连接顺序为:A→__→__→__→__→__→F(填各装置的字母代号)。__
(3)检查装置气密性后,先通一段时间N2,其目的是__,实验结束时熄灭A、C两处的酒精灯,继续通N2至常温,其目的是__。
(4)实验过程中观察到F中的溶液变浑浊,C中有红色固体生成,则气体产物__(填化学式)。
实验二:分解产物中固体成分的探究
(5)定性实验:经检验,固体成分含有K2CO3、FeO、Fe。
定量实验:将固体产物加水溶解、过滤洗涤、干燥,得到含铁样品。完成上述实验操作,需要用到下列仪器中的___(填仪器编号)。

设计下列三种实验方案分别对该含铁样品进行含量的测定
甲方案:ag样品![]() 溶液
溶液![]() 得固体bg
得固体bg
乙方案:ag样品![]() 测得气体体积VmL(标况)
测得气体体积VmL(标况)
丙方案:ag样品![]() 250mL溶液
250mL溶液![]() 三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
你认为以上方案中可以确定样品组成的有__方案。
(6)经测定产物中n(FeO):n(Fe)=1:1,写出K3[Fe(C2O4)3]3H2O分解的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为__________。
②NO3-的空间构型是____________________________________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为________。
②1 mol CO2中含有的σ键数目为____________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
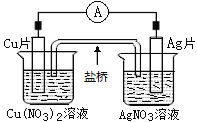
A.电子沿导线由Cu片流向Ag片
B.盐桥中的K+向Cu(NO3)2溶液
C.正极的电极反应是Ag++e-=Ag
D.Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com