
| A. | 与硫酸产生氢气多 | B. | 与氢氧化钠溶液产生氢气多 | ||
| C. | 两者产生氢气一样多 | D. | 无法判断 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
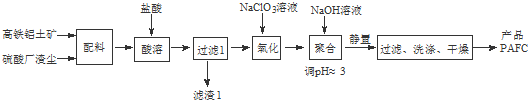
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯分子里的所有原子不可能在同一平面上 | |
| B. | 浓氨水洗涤做过银镜反应的试管 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物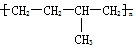 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4的质量是98 g/mol | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 摩尔质量建立了物质的物质的量与物质的质量之间的联系 | |
| D. | 1 mol任何物质的质量等于该物质的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
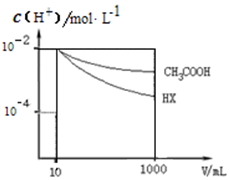 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂 厨房清洁剂 醋 肥皂 | |
| B. | 醋 厕所清洁剂 厨房清洁剂 肥皂 | |
| C. | 厕所清洁剂 醋 肥皂 厨房清洁剂 | |
| D. | 厨房清洁剂 厕所清洁剂 肥皂 醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
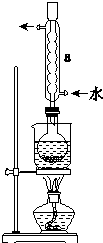 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com