
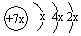 ,b与c形成化合物的电子式
,b与c形成化合物的电子式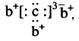 为下列比较中正确的是
为下列比较中正确的是| A.原子半径:a>c>d>b b | B.原子的氧化性a>b>d>c |
| C.原子序数:a>d>b>c | D.最高价含氧酸的酸性c>d>a |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
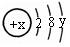 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | 价电子 对数 | 成键电 子对数 | 孤电子 对数 | 中心原子杂 化轨道类型 | 杂化轨道/电子 对空间构型 | 轨道 夹角 | 分子空 间构型 | 键角 |
| CO2 | | | | | | | | |
| BF3 | | | | | | | | |
| CH4 | | | | | | | | |
| H2O | | | | | | | | |
| NH3 | | | | | | | | |
| PCl3 | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第一电离能:B<C<N<O | B.最高正价:F>O>N>C |
| C.电负性:O>C>Si>Na | D.半径:Na + > Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com