
 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: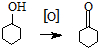
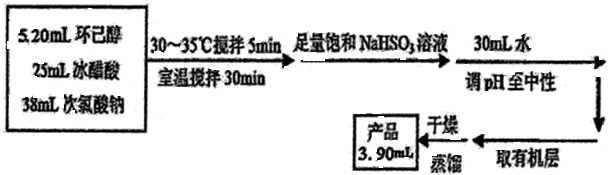
分析 (1)根据反应流程提供的反应物体积可知,反应物总体积约为5.2mL+25mL+38mL=68.2mL,而三颈瓶中液体的体积不能超过容积的$\frac{2}{3}$不少于$\frac{1}{3}$,据此答题;
(2)搅拌加速热量传递,NaClO水解吸热;
(3)次氯酸根能将亚硫酸氢根氧化,已经足量时溶液中无次氯酸根,可以用碘化钾淀粉试纸检验是否有次氯酸根;
(4)由(3)中分析可知溶液呈酸性;
(5)环己酮在氯化钠中的溶解度较小,环己酮和水互不相溶.
解答 解:(1)根据反应流程提供的反应物体积可知,反应物总体积约为5.2mL+25mL+38mL=68.2mL,而三颈瓶中液体的体积不能超过容积的$\frac{2}{3}$,实验用的三颈瓶应选用150mL规格,故答案为:B;
(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,而且NaClO水解吸热,因此要缓慢滴加NaClO溶液,
故答案为:搅拌器搅拌、缓慢滴加NaClO溶液;
(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO-+HSO3-═Cl-+H++SO42-;确保加入的饱和NaHSO3溶液已经足量,可以取少量烧瓶中的液体,加入碘化钾淀粉溶液,若看到溶液不显蓝色,则NaHSO3溶液已足量,
故答案为:ClO-+HSO3-═Cl-+H++SO42-;碘化钾淀粉溶液;溶液不显蓝色;
(4)由(3)中分析可知溶液呈酸性,可加入无水碳酸钠或氢氧化钠固体,可以使溶液变为中性,
故答案为:BD;
(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,可用分液漏斗分离,
故答案为:降低环己酮的溶解度,有利于环己酮分层;分液漏斗.
点评 本题以环己酮制备为载体,考查化学实验基本操作、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.


科目:高中化学 来源: 题型:填空题
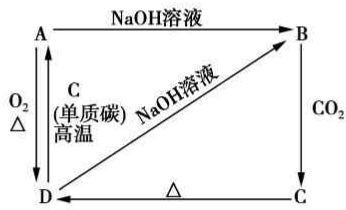 已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.
已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
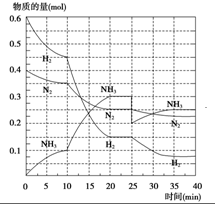 氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定不含有K+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀 | 该溶液中含有SO42- |
| D | 利用一束强光照射明矾溶液,产生光亮的“通路”, | 明矾一定发生了水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纤维素的水解难于淀粉的水解 | |
| B. | 碘化钾溶液能使淀粉变蓝 | |
| C. | 多糖一般没有还原性,不能发生银镜反应 | |
| D. | 用淀粉制酒精仅发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (填结构简式);
(填结构简式);查看答案和解析>>
科目:高中化学 来源: 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com