
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3  ②物质的熔点Li>Na>K
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.元素周期表中元素排序的依据是原子的核电荷数
B.元素周期表有16个纵行,也就是16个族
C.原子的最外层电子数相同的元素,一定属于同一族
D.电子层数相同的粒子,其对应元素一定属于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
 U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。 U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关 U说法正确的是( )
U说法正确的是( )
A. U原子核中含有92个中子 B.
U原子核中含有92个中子 B. U原子核外有143个电子
U原子核外有143个电子
C. U与
U与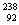 U互为同位素 D.
U互为同位素 D. U与
U与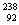 U互为同素异形体
U互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1) (2012·海南,9D)原子核内有18个中子的氯原子: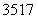 Cl ( )
Cl ( )
(2) (2008·广东理基,25A) Na2O2中氧元素的化合价为-2 ( )
Na2O2中氧元素的化合价为-2 ( )
(3) (2009·广东理基,19D)高氯酸(HClO4)中氯元素的化合价为+7 ( )
(4) (2010·课标全国卷,7D)Cl-的结构示意图为 ( )
( )
(5) (2012·天津理综,3C)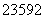 U和
U和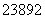 U是中子数不同质子数相同的同种核素 ( )
U是中子数不同质子数相同的同种核素 ( )
(6) (2009·山东理综,10B)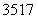 Cl、
Cl、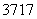 Cl为不同的核素,有不同的化学性质 ( )
Cl为不同的核素,有不同的化学性质 ( )
(7) (2010·山东理综,9B)16O与18O核外电子排布方式不同 ( )
(8) (2010·山东理综,9C)通过化学变化可以实现16O与18O间的相互转化 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢 |
(1)W位于元素周期表第______周期第______族,其基态原子最外层有______个电子。
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:________________。
(4)在X的原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:__________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3+5O2  4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
A.v (NO)=0.02 mol·(L·s)-1 B.v (NO)=0.2mol·(L·s)-1
C.v (NH3)=0.01 mol·(L·s)-1 D.v (NH3)=0.1 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学理论在元素单质及其化合物反应中应用广泛。
(1)在一定条件下,可逆反应mA nB+pC ⊿H,达到平衡状态。
nB+pC ⊿H,达到平衡状态。
①若A、B、C都是气体,增大压强,平衡向逆反应方向移动,则m (填“大于”、“小于”或“等于”)n+p。
②其他条件不变,加热后A的质量增加,则反应⊿H________0(填“大于”、“小于”或“等于”)。
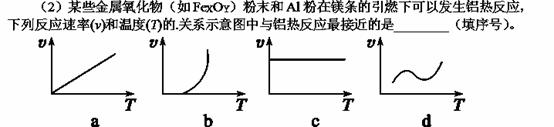 (3)一定温度下,发生反应:FeO(s)+CO(g)
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH。已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g) ΔH。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
请回答下列问题:
①该反应的ΔH___ 0(填“>”、“<”或“=”)。
②T℃时,将FeO(s)和CO(g)各3.0 mol加入10 L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2) =0.15mol·L-1,则温度T (填“高于”、“低于”、“等于”)1000, 若此时保持其它条件不变再充入2.0 mol CO(g),再达平衡时测得CO转化率为W2,则W1 (填“>”、“<”或“=”)W2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后恢复到原来的温度,下列说法中正确的是 ( )
A.溶液的pH增大,有O2放出
 B.溶液的pH不变,有O2放出
B.溶液的pH不变,有O2放出
C.溶液的c(Na+)增大,有O2放出
D.溶液的c(OH-)增大,有O2放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com