
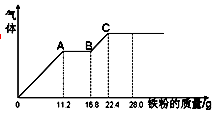
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:分析 (1)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
(2)消耗22.4g Fe时,此时溶液中溶质为FeSO4,根据守恒可知n(H2SO4)=n(FeSO4)=n(Fe),进而计算硫酸的浓度.
解答 解:(1)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每份中n(NO3-)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,故c(NO3-)=$\frac{0.2mol}{0.1L}$=2mol/L,
答:原混合溶液中硝酸根离子的物质的量浓度为2mol/L;
(2)消耗22.4g Fe时,此时溶液中溶质为FeSO4,根据守恒可知n(H2SO4)=n(FeSO4)=n(Fe)=$\frac{22.4g}{56g/mol}$=0.4mol,故c(H2SO4)=$\frac{0.8mol}{0.1L}$=8mol/L,
答:原混合溶液中硫酸的物质的量浓度为8mol/L.
点评 本题以化学反应图象为载体,考查有关金属和酸反应的计算题,难度中等,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,注意利用守恒思想解答.


科目:高中化学 来源: 题型:选择题
| A. | W、X、Y元素的简单离子对水的电离平衡的影响是相同的 | |
| B. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | Y元素所形成的离子是其所在周期中半径最小的简单离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
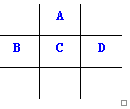 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: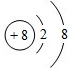 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{醇溶液}^{NaOH}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和NO2是主要的大气污染物 | |
| B. | 大气中的SO2和CO2溶于水形成酸雨 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 对煤燃烧后形成的烟气脱硫,目前主要用石灰法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下混合气体的体积为22.4L | |
| B. | 完全燃烧生成44g CO2 | |
| C. | 混合气体中氢原子个数为2NA | |
| D. | 完全燃烧转移的电子数为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
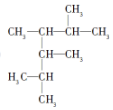 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷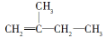 2-甲基-1-丁烯
2-甲基-1-丁烯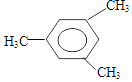 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com