
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX >rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
D
【解析】
试题分析: Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X是Na元素。Q元素的原子最外层电子数是其内层电子数的2倍,则Q是第二周期的碳元素。W、Z最外层电子数相同,Z的核电荷数是W的2倍,所以同主族元素中满足此关系的是O和S,即W是O,Z是S。元素Y的合金是日常生活中使用最广泛的金属材料之一,则Y是Al元素。A.同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,则原子半径的大小顺序:rX> rY >rQ>rW,A错误;B.X、Y的最高价氧化物的水化物氢氧化钠与氢氧化铝能发生反应生成偏铝酸钠和水,B错误;C.氧元素的非金属性强于硫元素,则Z元素的氢化物稳定性小于W元素的氢化物稳定性,C错误;D.元素Q和Z能形成CS2型的共价化合物,D正确,答案选D。
考点:考查元素周期表的结构与元素周期律的应用


科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:填空题
(10分)氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:

(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是: 。
②样品中氯化铁的质量分数为 (用字母m、C、V来表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:填空题
(12分)前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满。
(1)写出E2+的基态核外电子排布式 。
(2)A和C可以形成18电子的分子,该分子中C原子的杂化方式为 。
(3)C与D形成的酸根离子CD3-
①CD3-的空间构型为 (用文字描述)。
②写出一种与CD3-互为等电子体的分子的化学式 。
(4)CA3的沸点比BA4的沸点高的原因是 。
(5)E2+与C的常见氢化物形成配位数为4的配合物离子,1mol该离子中含σ键数目为 。
(6)E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系均正确的是
A.SO2具有漂白性,可用SO2加工银耳,使之更白
B.炭具有强还原性,常用于冶炼镁、钠等金属
C.淀粉遇碘变蓝色,常用于检验食盐是否为加碘盐
D.NaHCO3可以与胃酸反应,可用NaHCO3治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:填空题
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
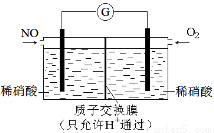
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。

(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:填空题
【化学——选修5有机化学基础】(15分)
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。

(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式 (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管 中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色 气体 | 溶液中NO3—被 Fe2+还原为NO2 |
B | 向饱和Na2CO3溶液中通入足 量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
C | 等体积pH=2的HX和HY两 种酸分别与足量的铁反应,排 水法收集气体 | HX放出的氢气多且 反应速率快 | HX酸性比HY弱 |
D | 先向2mL0.1mol/LNa2S溶液中 滴几滴0.1mol/LZnSO4溶液,再 加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是
A.家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故
B.在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的
C.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
D.可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:计算题
(6分)计算题(写出计算过程)
将11g铝铁合金的粉末放入100mL过量的KOH溶液中充分反应,得到标准状况下6.72L H2。试计算:
(1)该合金中铝的质量分数(保留两位有效数字);
(2)该合金中铝和铁的物质的量之比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com