
 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-,溶液呈碱性,
Al(OH)3+OH-,溶液呈碱性, Al(OH)3+OH-;
Al(OH)3+OH-;

科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
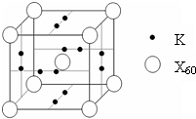 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下.下列说法错误的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
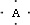 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.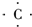 +4H?→
+4H?→
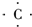 +4H?→
+4H?→
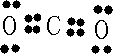
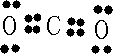
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com