
| A. | 一位同学 | B. | 二位同学 | C. | 三位同学 | D. | 四位同学 |
分析 强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,要证明醋酸是弱电解质,只要能证明醋酸部分电离即可,据此分析解答.
解答 解:甲.用pH试纸测出0.10mol/L的醋酸溶液pH=4,醋酸中氢离子浓度小于醋酸浓度,说明醋酸部分电离,则醋酸为弱电解质,故正确;
乙.将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,说明醋酸中存在电离平衡,为弱电解质,故正确;
丙.将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的pH变化大,说明醋酸中存在电离平衡,加入相应的钠盐抑制醋酸电离,为弱电解质,故正确;
丁.取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,测量醋酸放出H2的速率快,说明稀释后醋酸中氢离子浓度大于盐酸,稀释过程中醋酸继续电离生成氢离子,所以醋酸中存在醋酸电离平衡,为弱电解质,故正确;
故选D.
点评 本题考查弱电解质的判断,为高频考点,明确强弱根本区别是解本题关键,电解质强弱与其电离程度有关,与溶液导电性及溶质溶解性强弱无关,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的Na2O2为(x+y)mol | |
| B. | 反应后容器内有O2 (x+y) mol | |
| C. | 反应前后容器内压强之比为(温度不变):(x+y+z)/z | |
| D. | 反应后生成了x mol Na2CO3 和2y mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
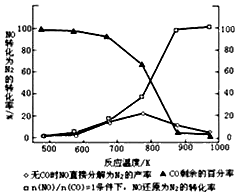 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
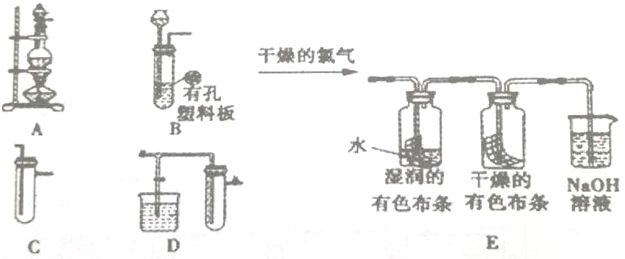
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com