
【题目】对高温条件下反应机理的研究一直是化学动力学的重要课题,科研工作者研究了1000K下丙酮的热分解反应并提出了如下反应历程:
![]() ①
①![]()
![]() ②
②![]()
![]() ③
③![]()
![]() ④
④![]()
![]() ⑤
⑤![]()
回答下列问题:
(1)上述历程是根据两个平行反应提出的,其中一个为CH3COCH3![]() CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,写出该反应的化学方程式:____________________________________。
(3)一定温度下,在2L密闭容器中充入1molCH3COCH3发生上述两个平行反应,提高乙烯酮反应选择性的关键因素是___________;
a.再充入1molCH3COCH3 b.及时分离出CH4 c.使用适宜的催化剂
达到平衡后,测得容器中存在a molCH4和b mol CO,则CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
(4)分解产物中的CH4可用于制备氢气:
反应I:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1
CO(g)+3H2(g) △H=206.2kJ·mol-1
反应Ⅱ:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1
CO2(g)+4H2(g) △H=165.0kJ·mo1-1
写出CO与水蒸气反应生成CO2的热化学方程式:_________________。830℃时,反应Ⅱ的平衡常数K=1.2mol2·L-2,该温度下,测得密闭容器中各物质的浓度为c(CH4)=2.0mol·L-1、c(H2O)=4.0mol·L-1、c(CO2)=2.0mol·L-1、c(H)=2.0mol·L-1,则此时v正_____v逆(填“>”“<”或“=”)。
【答案】① 2CH3COCH3![]() CH4+CO+C2H5COCH3 < CH2=C=O+CH3CH2OH→CH3COOCH2CH3 c a(a-b)/(2-2a-2b) CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1 >
CH4+CO+C2H5COCH3 < CH2=C=O+CH3CH2OH→CH3COOCH2CH3 c a(a-b)/(2-2a-2b) CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1 >
【解析】
(1)根据反应历程分析,两个平行反应为:①CH3COCH3![]() CH4+CH2=C=O、②2CH3COCH3
CH4+CH2=C=O、②2CH3COCH3![]() CH4+CO+C2H5COCH3,①反应的快慢主要由上述历程中活化能大的反应①决定,根据反应④和反应⑤,反应④生成甲基自由基,甲基自由基浓度增大,比较反应④和⑤的活化能,反应⑤速率更快,则反应速率常数k4<k5,故答案为:①;2CH3COCH
CH4+CO+C2H5COCH3,①反应的快慢主要由上述历程中活化能大的反应①决定,根据反应④和反应⑤,反应④生成甲基自由基,甲基自由基浓度增大,比较反应④和⑤的活化能,反应⑤速率更快,则反应速率常数k4<k5,故答案为:①;2CH3COCH![]() CH4+CO+C2H5COCH3;<;
CH4+CO+C2H5COCH3;<;
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,该反应的化学方程式:CH2=C=O+CH3CH2OH→CH3COOCH2CH3,故答案为:CH2=C=O+CH3CH2OH→CH3COOCH2CH3;
(3)提高乙烯酮反应选择性的关键因素是催化剂的选择;达到平衡时,根据2CH3COCH3![]() CH4+CO+C2H5COCH3反应中,生成的CO为bmol,则该反应中生成的CH4也是bmol,所以CH3COCH3(g)
CH4+CO+C2H5COCH3反应中,生成的CO为bmol,则该反应中生成的CH4也是bmol,所以CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)反应中,生成的CH4是(a-b)mol,CH2=C=O等于(a-b)mol,剩下的CH3COCH3的物质的量为(1-a-b)mol,则反应CH3COCH3(g)
CH4(g)+CH2=C=O(g)反应中,生成的CH4是(a-b)mol,CH2=C=O等于(a-b)mol,剩下的CH3COCH3的物质的量为(1-a-b)mol,则反应CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)的平衡常数为
CH4(g)+CH2=C=O(g)的平衡常数为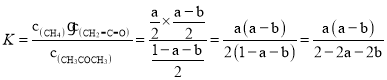 mol·L-1,故答案为:c;
mol·L-1,故答案为:c;![]() ;
;
(4)①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1;②CH4(g)+2H2O(g)
CO(g)+3H2(g) △H=206.2kJ·mol-1;②CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1;根据盖斯定律②-①可的:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;830℃时,
CO2(g)+4H2(g) △H=165.0kJ·mo1-1;根据盖斯定律②-①可的:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;830℃时,![]() ,所以正反应速率大于逆反应速率,故答案为:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;>。
,所以正反应速率大于逆反应速率,故答案为:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;>。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与硼(5B)同主族,与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素B.![]() 的中子数与电子数的差值为17
的中子数与电子数的差值为17
C.原子半径:In>AlD.碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含铁废铜制备胆矾的流程如下图所示:
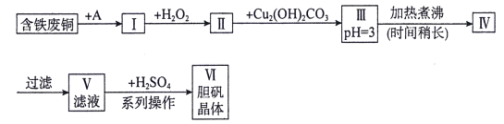
下列说法错误的是( )
A.物质A可选用盐酸
B.I中加H2O2的目的是溶解铜并将Fe2+氧化为Fe3+
C.长时间煮沸Ⅲ中悬浊液的目的是充分聚沉Fe(OH)3
D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )
A.已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
B.由C(石墨,s)![]() C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件的ΔH不同
2HCl(g)在光照和点燃条件的ΔH不同
D.化学变化不一定都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1molFe3O4,转移电子的物质的量为2mol
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明,AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60mL·min-1)和氨气(20mL·min-1)气氛中于650℃热处理2h可制得氨气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是_____________。为了防止放置过程中再次吸水,烘干后的AC应置于_________(填仪器名称)中备用。
(2)制备ACN:
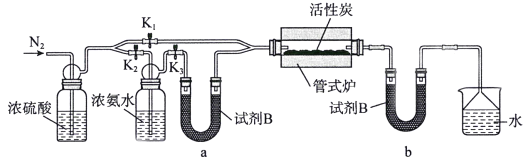
检查装置气密性并加入药品后,加热前应进行的操作是_________,其目的是_________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为______________。U型管b内试剂B的作用是____________________。
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN 0.5g,加入0.05mol· L-1的X溶液a mL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为bmL。则X为________(填“NaOH”“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为______mol·kg-1(已知:ACN中,羧基的Ka=1.0×10-4、酚羟基的Ka=5.0×10-9、碳酸的Ka1=4.2×10-7、Ka2=5.6×10-11;用含a、b的代数式表示)。
(4)某课题组以2500mg·L-1苯酚溶液为模型废水,研究AC和ACN表面的酸碱性对H2O2降解苯酚的影响,得到如下图像:
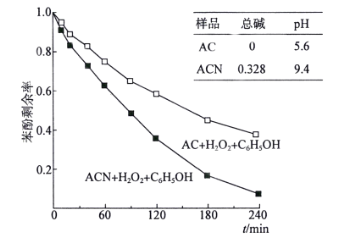
由图像可知,________(填“AC”或“ACN”)更有利于H2O2降解苯酚,原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于化合反应的是
A.Zn+2AgNO3=Zn(NO3)2+2AgB.2FeCl2+Cl2=2FeCl3
C.Cu(OH)2+2HCl=CuCl2+2H2OD.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和水蒸气分别为1 mol、3 mol,在密闭容器中发生反应CO+H2O(g)![]() CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com