
| A. | 一定含有乙烯 | |
| B. | 可能为等物质的量甲烷和丙烯的混合物 | |
| C. | 可能为乙烷和丙烷的混合物 | |
| D. | 一定为乙烯和甲烷的混合物 |
分析 两种气态烃的混合物共1mol,在空气中完全燃烧生成2mol CO2气体和2.5mol水蒸气,则混合烃含有2molC、5molH原子,平均分子式为C2H5,以此解答该题.
解答 解:两种气态烃的混合物共1mol,在空气中完全燃烧生成2mol CO2气体和2.5mol水蒸气,则混合烃含有2molC、5molH原子,平均分子式为C2H5,
如两种烃C原子数都为2,可为乙烯、乙烷;
如C原子数不等,则一定含有甲烷,另一种有机物可能为丙烯等,
则只有B正确.
故选B.
点评 本题考查了有机物分子组成的推断,题目难度中等,反应物和生成物之间体积关系确定气态烃的平均化学式,再利用平均化学式来分析解答,试题有利于培养学生的分析、理解能力.


科目:高中化学 来源: 题型:解答题
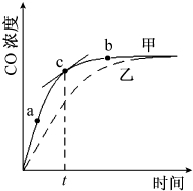 ①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
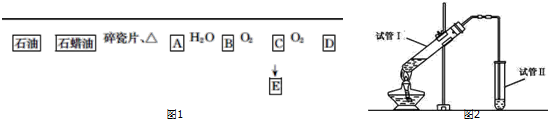
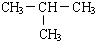 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
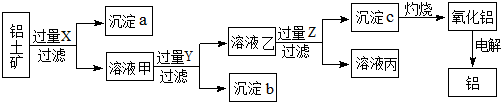
| A. | 实验室中灼烧操作通常在坩埚中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 上述过程中所发生的反应有分解反应、复分解反应、氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
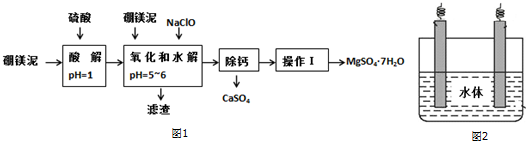
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com