
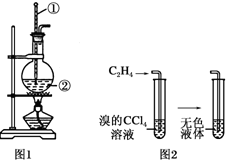
 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:分析 乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯,乙烯不溶于水,密度与空气相近,可用排水法收集,乙烯含有碳碳双键,可发生加成反应,可使溴的四氯化碳溶液褪色,以此解答该题.
解答 解:(1)图1中仪器①用于测量反应温度,名称为温度计;仪器②由于盛放乙醇和浓硫酸的混合液,名称为圆底烧瓶,
故答案为:温度计;圆底烧瓶;
(2)乙烯的密度与空气密度接近,不能使用排空气法收集,乙烯不溶于水,可以用排水法收集乙烯,
故答案为:排水集气法;
(3)向溴的四氯化碳溶液中通入乙烯(如图2),乙烯与溴发生加成反应生成1,2-二溴乙烷,所以溶液的颜色很快褪去,反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成反应;CH2=CH2+Br2→CH2BrCH2Br.
点评 本题主要考查了乙烯的实验室制法以及性质的检验,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意掌握常见仪器的干燥及使用方法,明确乙烯的实验室制法及反应原理.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阳极上析出红色固体 | B. |  装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
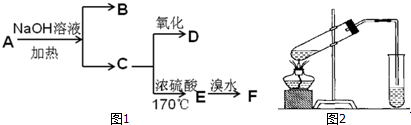
 ,反应类型氧化反应;
,反应类型氧化反应; ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅤⅡA族的为最大 | |
| B. | 同主族元素两种元素原子的核外电子数的差值可能为26 | |
| C. | 短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| D. | 同周期第ⅡA族和ⅢA族元素的原子序数之差不可能为25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com