

分析 (1)纯ClO2易分解爆炸,鼓入空气的作用应是稀释ClO2;
(2)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=$\frac{n}{V}$计算氢氧化钠溶液的物质的量浓度;
(3)在吸收塔内,ClO2将进一步生成NaClO2.可被过氧化氢氧化;
(4)从溶液中得到含结晶水的晶体,采取蒸发、浓缩、冷却结晶方法.
解答 解:(1)由信息可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,故答案为:B;
(2)160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,则160gNaOH的物质的量为$\frac{160g}{40g/mol}$=4mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=$\frac{4mol}{1L}$=4mol/L.在实验室若要配制500mL该物质的量浓度NaOH溶液,应称取NaOH的质量为0.5L×160g/L=80.0g,
故答案为:4;80.0;
(3)在吸收塔内,ClO2将进一步生成NaClO2.可被过氧化氢氧化,反应的化学方程式为2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2↑,
故答案为:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2↑;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,故答案为:B、E、D.
点评 本题考查物质制备,综合性较强,涉及氧化还原反应、物质分离和提纯的综合应用,明确物质性质及实验基本操作原理是解本题关键,需要学生较强的综合能力,难度较大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CH2Cl2所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 常温常压下,16gO2和O3的混合气体含有的氧原子数为NA | |
| D. | 1molCaC2所含阴离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | |
| B. | 原子半径:X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 最简单气态氢化物的稳定性:X>W>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| B. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与盐酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 0.1 mol•L-1 Na2CO3溶液中,存在关系:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 加热0.1 mol•L-1 NaClO溶液测其pH,pH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | 根据上表数据得出三种酸电离平衡常数大小关系为:HF>HClO>H2CO3(一级电离平衡常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

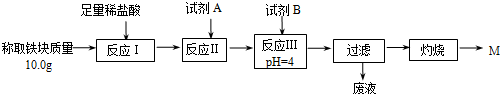
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
| 操作 | 预期现象 |
| 取少量M固体于试管中,向其中加入足量稀硫酸;观察. | 固体完全溶解,溶液呈黄色. |
继续向上述溶液中滴入几滴(少量)高锰酸钾溶液,振荡观察 | 溶液紫红色未褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com