
分析 化学式和离子符号表示电离过程的式子,称为电离方程式,首先判断电解质的类型及电离出的阴阳离子,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,然后根据电解质的类型判断写可逆号还是等号,如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒,据此即可解答.
解答 解:(1)硫酸电离时生成氢离子、硫酸根离子,其电离方程式为H2SO4═2H++SO42-,
故答案为:H2SO4═2H++SO42-;
(2)Ba(OH)2在溶液中电离生成Ba2+离子和OH-离子,电离方程式为Ba(OH)2=Ba2++2OH-,
故答案为:Ba(0H)2═Ba2++2OH-;
(3)Al2(SO4)3为强电解质,完全电离出铝离子和硫酸根离子,则电离方程式为:Al2(SO4)3═2Al3++3SO42-,
故答案为:Al2(SO4)3═2Al3++3SO42-.
点评 本题考查电离方程式的书写,书写电离方程式时注意离子的正确书写、电荷守恒、离子团不能拆开,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 大于10% 小于55% | B. | 小于10% | C. | 等于10% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向水中加入少量硫酸氢钠固体 | B. | 向水中加入少量硫酸铝固体 | ||
| C. | 向水中加入少量氯化铵固体 | D. | 将水加热到100℃,使水的pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀铜时,电解质溶液中铜离子浓度不断减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,会使反应速率减慢 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人CuO固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 | |
| D. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
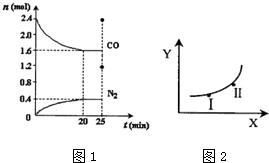
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
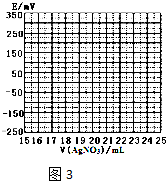
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+2H2O=4HF+O2↑ | D. | 2Na+2H2O=2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | A | B | C | |||||
| 三 | D | E | F | G |
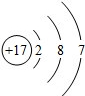 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com