
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
分析 A、CH3COONH4促进水的电离;
B、难溶电解质之间可实现由溶度积常数较大的物质转化为溶度积常数较小的物质;
C、根据C(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$;
D、含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,配位体中络离子中氯离子不能反应生成沉淀.
解答 解:A、CH3COONH4促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故A错误;
B、当溶液中c(Ba2+)×c(CO32-)>9.1×10-6时,可实现BaSO4沉淀转化成BaCO3沉淀,故B错误;
C、常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子的浓度降低,由C(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$可知氢氧根离子的浓度增大,故C错误;
D、含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,配位体中络离子中氯离子不能反应生成沉淀,含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀,故D正确;
故选D.
点评 本题考查了弱电解质的电离、沉淀溶解平衡分析,明确溶液中的溶质、溶液的酸碱性、络离子的性质即可解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 在镀件上电镀铜时可用镀件作阳极,电极反应式为:Cu2++2e-═Cu | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
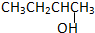 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③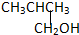 ④
④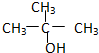
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
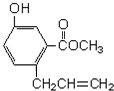
| A. | 一定条件下和浓溴水反应时,1mol A能消耗3molBr2 | |
| B. | 一定条件下,1mol A能和5mol氢气发生加成反应 | |
| C. | 一定条件下,1mol A能与3molNaOH反应 | |
| D. | A能与碳酸氢钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红褐色溶液物质是Fe(OH)3胶体,气泡的成分是H2 | |
| B. | 红褐色沉淀是Fe(OH)3沉淀,黑色的物质是Fe | |
| C. | 除去红褐色溶液中少量沉淀的实验方法是参析 | |
| D. | 由于Fe3+在溶液中被水分子包围形成[Fe(H2O)4]3+,不利于铝粉与Fe3+的接触反应,所以只生成少量的单质铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素的最高正价从左向右依次从+1递增到+7价 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在金属与非金属分界线附近寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com