
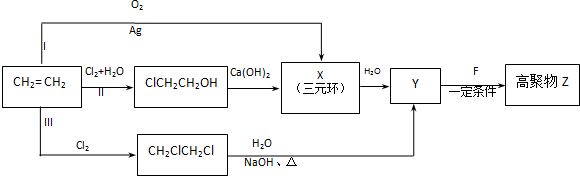
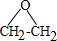 .
.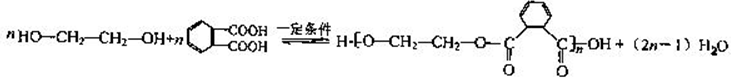 CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl. 分析 乙烯在Ag作催化剂条件下被氧气氧化生成X,X是三元环,且ClCH2CH2OH和氢氧化钙反应也生成X,则X为环氧乙烷,其结构简式为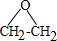 ,1,2-二氯乙烷和氢氧化钠的水溶液加热生成Y,则Y的结构简式为HOCH2CH2OH,1mol F在O2中充分燃烧,生成CO2 和H2O的物质的量之比为 8:3,消耗7.5mol O2,则碳氢个数比为4:3,F能与NaHCO3反应生成CO2,说明F中含有羧基,不能使Br2的CCl4溶液褪色,说明不含有碳碳双键,其分子内的氢原子处于3种不同的化学环境,则F的结构简式为
,1,2-二氯乙烷和氢氧化钠的水溶液加热生成Y,则Y的结构简式为HOCH2CH2OH,1mol F在O2中充分燃烧,生成CO2 和H2O的物质的量之比为 8:3,消耗7.5mol O2,则碳氢个数比为4:3,F能与NaHCO3反应生成CO2,说明F中含有羧基,不能使Br2的CCl4溶液褪色,说明不含有碳碳双键,其分子内的氢原子处于3种不同的化学环境,则F的结构简式为 ,Y和F在浓硫酸作催化剂、加热条件下发生缩聚反应生成Z,则Z的结构简式为
,Y和F在浓硫酸作催化剂、加热条件下发生缩聚反应生成Z,则Z的结构简式为 ,据此答题;
,据此答题;
解答 解:乙烯在Ag作催化剂条件下被氧气氧化生成X,X是三元环,且ClCH2CH2OH和氢氧化钙反应也生成X,则X为环氧乙烷,其结构简式为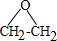 ,1,2-二氯乙烷和氢氧化钠的水溶液加热生成Y,则Y的结构简式为HOCH2CH2OH,1mol F在O2中充分燃烧,生成CO2 和H2O的物质的量之比为 8:3,消耗7.5mol O2,则碳氢个数比为4:3,F能与NaHCO3反应生成CO2,说明F中含有羧基,不能使Br2的CCl4溶液褪色,说明不含有碳碳双键,其分子内的氢原子处于3种不同的化学环境,则F的结构简式为
,1,2-二氯乙烷和氢氧化钠的水溶液加热生成Y,则Y的结构简式为HOCH2CH2OH,1mol F在O2中充分燃烧,生成CO2 和H2O的物质的量之比为 8:3,消耗7.5mol O2,则碳氢个数比为4:3,F能与NaHCO3反应生成CO2,说明F中含有羧基,不能使Br2的CCl4溶液褪色,说明不含有碳碳双键,其分子内的氢原子处于3种不同的化学环境,则F的结构简式为 ,Y和F在浓硫酸作催化剂、加热条件下发生缩聚反应生成Z,则Z的结构简式为
,Y和F在浓硫酸作催化剂、加热条件下发生缩聚反应生成Z,则Z的结构简式为 ,
,
(1)由乙烯合成高聚物Z的3条路线Ⅰ无副产物,符合“原子经济”要求,Ⅱ、Ⅲ都有副产物CaCl2和水,不符合“原子经济”要求,
故答案为:I;
(2)通过以上分析知,X的结构简式是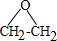 ,故答案为:
,故答案为: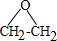 ;
;
(3)通过以上分析知,F的结构简式为 ,其含氧官能团名称是羧基,
,其含氧官能团名称是羧基,
故答案为:羧基;
(4)Y和F在浓硫酸作催化剂、加热条件下发生缩聚反应生成Z,该反应方程式为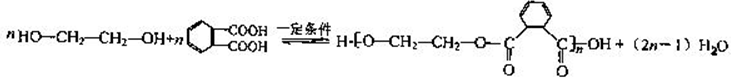 ,
,
CH2ClCH2Cl在碱性条件下水解得Y,反应的方程式为CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl,
故答案为: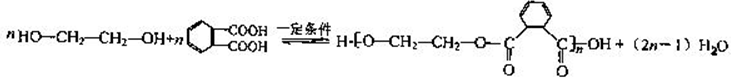 ;CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
;CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
点评 本题考查有机物推断,侧重考查分析、推断、知识迁移能力,熟练掌握常见有机物的官能团及其性质,注意结合题给信息进行推断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 常温下,11.2 L Cl2 气所含原子数为NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时,切取绿豆粒大小的金属钠,用滤纸吸干表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 用蒸馏法提纯物质时,如果把温度计水银球位于蒸馏烧瓶支管口下方,会使收集的产品中混有低沸点的杂质 | |
| C. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸,加热3~5min,将导气管插入饱和Na2CO3溶液中以便于除去乙醇和乙酸 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s 的平均速率 (PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时 (PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前 (正)>(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com