

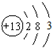 ;
;分析 甲、乙、丙是都含有同一种元素的不同物质,
(1)若甲是CO2,根据各物质转化关系,二氧化碳与氢氧化钠反应生成乙为Na2CO3,Na2CO3与硫酸反应生成丙为NaHCO3;
(2)若甲是Al,根据各物质转化关系,Al与氢氧化钠反应生成乙为NaAlO2,NaAlO2与硫酸按1:2反应生成丙为Al2(SO4)3;
(3)若甲是Cl2,根据各物质转化关系,Cl2与氢氧化钠反应生成乙为NaClO,NaClO与硫酸反应生成丙为HClO;根据盖斯定律可知,将反应①TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ•mol-1和反应②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1相减可得TiO2和Cl2反应生成TiCl4和O2的热化学方程式;根据Ka=$\frac{c({H}^{+})•c(C{lO}^{-})}{c(HClO)}$计算电离平衡常数;
解答 解:甲、乙、丙是都含有同一种元素的不同物质,
(1)若甲是CO2,根据各物质转化关系,二氧化碳与氢氧化钠反应生成乙为Na2CO3,Na2CO3与硫酸反应生成丙为NaHCO3;
①常用于泡沫灭火器的是NaHCO3,
故答案为:丙;
②由于等浓度的Na2CO3的水解程度大于NaHCO3,所以Na2CO3溶液中水的电离程度大于NaHCO3,
故答案为:乙;
(2)若甲是Al,根据各物质转化关系,Al与氢氧化钠反应生成乙为NaAlO2,NaAlO2与硫酸按1:2反应生成丙为Al2(SO4)3,
①Al的原子结构示意图为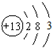 ,
,
故答案为: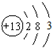 ;
;
②根据上面的分析可知,丙的化学式为Al2(SO4)3,
故答案为:Al2(SO4)3;
(3)若甲是Cl2,根据各物质转化关系,Cl2与氢氧化钠反应生成乙为NaClO,NaClO与硫酸反应生成丙为HClO,
①甲转化为乙的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②根据盖斯定律可知,将反应①TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ•mol-1和反应②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1相减可得TiO2和Cl2反应生成TiCl4和O2的热化学方程式为TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140 kJ•mol-1,
故答案为:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140 kJ•mol-1;
③将a mol•L-1乙溶液和0.01mol•L-1H2SO4溶液等体积混合生成丙,溶液呈中性,生成的c(HClO)≈0.01mol•L-1 ,根据电荷守恒可知,c(ClO-)=c(Na+)-2c(SO42-)=$\frac{a-0.02}{2}$mol•L-1 =,根据Ka=$\frac{c({H}^{+})•c(C{lO}^{-})}{c(HClO)}$得Ka=$\frac{\frac{a-0.02}{2}×1{0}^{-7}}{0.01}$mol•L-1=($\frac{a}{2}$-0.01)×10-5mol•L-1,
故答案为:=($\frac{a}{2}$-0.01)×10-5mol•L-1;
点评 本题主要考查了非金属元素的性质,中等难度,解题时要注意充分运用常见非金属元素及其化合物的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释10倍后,溶液的pH=4 | |
| B. | c(SO32-)+c(OH-)=c(H2SO3)+c(HSO3-) | |
| C. | 2c(SO32-)+c(HSO3-)+c(H2SO3)=0.02mol•L-1 | |
| D. | $\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$约为5×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (0.4 Q1+0.05 Q3) kJ | B. | (0.4 Q1+0.05 Q2) kJ | ||
| C. | (0.4 Q1+0.1 Q3) kJ | D. | (0.4Q1+0.2 Q1) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失 | |
| B. | 向Na2CO3饱和溶液中通入CO2溶液变浑浊,继续通入CO2,有晶体析出 | |
| C. | 向Ca(ClO)2溶液中通入CO2溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com