
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如图所示。下列说法不正确的是
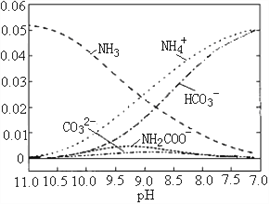
A. 当8.5<pH<10.5时,会有中间产物(NH2COOˉ)生成
B. 在pH=9.5时,溶液中存在关系:c(NH4+)>c(HCO3ˉ)>c(NH2COOˉ)>c(CO32ˉ)
C. 在pH=9.0时,溶液中存在关系:c(NH4+)+c(H+)=2c(CO32ˉ)+c(HCO3ˉ)+c(NH2COOˉ)+c(OHˉ)
D. 随着CO2的通入,![]() 不断减小
不断减小
【答案】D
【解析】A.由图像可知开始没有NH2COO-,后来也不存在NH2COO-,在8.5<pH<10.5时,存在NH2COO-,所以NH2COO-为中间产物,故A正确;B.pH=9.5时,图像中各种离子浓度的大小关系:c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),故B正确;C.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),故C正确;D.已知Kb=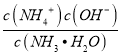 ,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则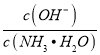 不断减小,则
不断减小,则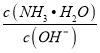 不断增大,故D错误;故选D。
不断增大,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为_____________;正极材料是__________,正极反应为_______________。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO![]() -4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
-4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为_________。
(4) “镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为_________________。
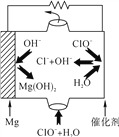
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是( )
A.酸性:HClO4>HBrO4B.稳定性:HF>HClC.碱性:KOH>NaOH>LiOH D.原子半径:S>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:1克碳粉燃烧全部生成CO气体时放出9.2kJ热量,2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________________________________________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢可制取甲醛:
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
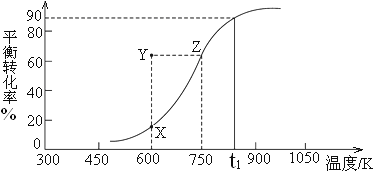
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的υ(正) ____υ(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, t1K时,该反应的平衡常数K=____________。
(3)研究表明,纳米级的Cu2O也可作为太阳光分解水的催化剂。
① 其他条件不变时,若水的分解反应使用Cu2O催化剂与不使用催化剂相比,使用催化剂会使该反应的活化能___________ (填“增大”、“减小”或“不变”),反应热(ΔH)______(填“增大”、“减小”或“不变”)。
② 如图所示,当关闭K时,向容器A、B中分别充入0.04molH2O(g),起始时V(A) = V(B) = 2L。在一定条件下使水分解(反应过程中温度保持不变,B中活塞可以自由滑动),达到平衡时,V(B) = 2.4L。平衡时,两容器中H2O(g)的分解率A_____________B (填“<”、“=”或“>”)。打开K,过一段时间重新达平衡时,B的体积为____________L。(连通管中气体体积不计)。
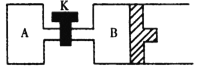
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
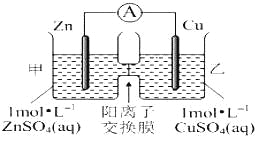
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家可以通过__________法发现太阳存在有大量的铁元素,写出基态Fe原子的价电子排布图__________________。从结构上分析Fe3+比Fe2+稳定的原因:________________________。
(2)SCN-常用来检测Fe3+的存在,SCN-中心原子的杂化方式为_________,三种元素电负性由大到小的顺序为__________________。
(3)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_________(填化学式),其理由是________________________。
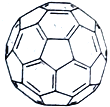
(4)C60分子又名足球烯,它是由60个碳原子组成的球状分子,右图为C60结构图。一个C60分子中六元环的数目为____________,在C60晶胞中C60分子的配位数为___________。已知C60分子的球体 半径为a nm,求C60晶体的ρ=_________g/cm3。(用NA表示阿伏加德罗常数,写出表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com