
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
分析 A.碳酸为多元弱酸,分步电离,以第一步为主;
B.次氯酸为弱酸部分电离生成氢离子与次氯酸根离子;
C.碳酸氢钠为盐,属于强电解质,完全电离生成钠离子与碳酸氢根离子;
D.熔融状态下硫酸氢钠完全电离生成钠离子与硫酸氢根离子.
解答 解:A.碳酸电离方程式:H2CO3?H++HCO3-,故A错误;
B.次氯酸为弱酸部分电离生成氢离子与次氯酸根离子,电离方程式;HClO+H2O?H3O++ClO-,故B正确;
C.碳酸氢钠为盐,属于强电解质,完全电离生成钠离子与碳酸氢根离子,电离方程式:NaHCO3=Na++HCO3-,故C错误;
D.在熔化时硫酸氢钠完全电离生成钠离子与硫酸氢根离子,电离方程式:NaHSO4═Na++HSO4-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意多元弱酸分步电离,硫酸氢钠熔融状态下只破坏离子键,题目难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:${\;}_{6}^{18}$O | |
| B. | 氯原子的结构示意图: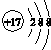 | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | 基态铜原子的外围电子排布图: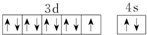 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
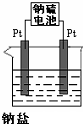
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的Ba(NO3)2溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HNO3无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向溶液中加入少量KSCN溶液 | 有血红色溶液生成 | 溶液中含有Fe2+ |
| D | 向硫酸铜溶液中持续滴加氨水溶液 | 先有蓝色沉淀生成后溶解 | 氢氧化铜发生反应生成了[Cu(NH3)4]2+离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.032mol•L-1 | B. | 0.036mol•L-1 | C. | 0.04mol•L-1 | D. | 0.045mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
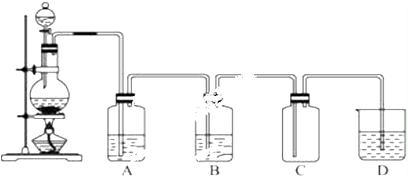
 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
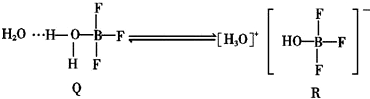
| A. | 离子键 | B. | 配位键 | C. | 非极性共价键 | D. | 氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com