
| T/�� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
���� ��1����֪���٣�CH4��g��+H2O��g��?CO��g��+3H2��g����H=+206.2kJ/mol
�ڣ�CH4��g��+2H2O��g��?CO2��g��+4H2��g����H=+165.0kJ/mol
���ݸ�˹���ɣ���-�ٿɵã�CO��g��+H2O��g��?CO2��g��+H2��g�������ʱ�=�ڵ��ʱ�-�ٵ��ʱ䣻
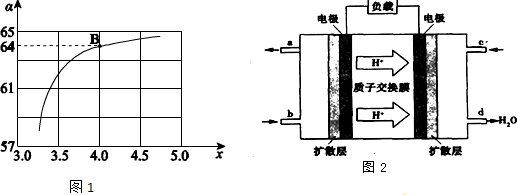
��2�����ɱ������ݿ�֪�������¶ȵ����ߣ��÷�Ӧ��ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ��������¶�ƽ�������ȷ����ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
��B��ĺ�����Ϊ4.0��������Ϊ64%����$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$=4.0��CO2��ƽ��ת����Ϊ64%������ʼʱCO2�����ʵ���Ϊ1mol����NH3�����ʵ���Ϊ4.0mol��CO2�ı仯���ʵ���Ϊ0.64mol����
2NH3��g��+CO2��g��?CO��NH2��2��l��+H2O��l��
��ʼ����mol����4.0 1.0
�仯����mol����1.28 0.64
ƽ������mol����2.72 0.36
ת����=$\frac{���ʵ����仯��}{��ʼ���ʵ���}$��100%��
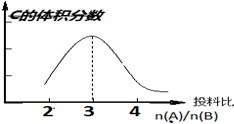
��3��ȼ�ϵ�ع���ʱ���ڵ�·�������ӴӸ����������ƶ����۲��������ȼ�ϵ��װ��ͼ��֪����ߵ缫Ϊ�������ұߵ缫Ϊ�����������ڸ����Ϸ���������Ӧ�����ɵĶ�����̼�������������Ե������Һ����a�ڷų��������Ƕ�����̼���壻�����������Ϸ�����ԭ��Ӧ���������ӽ������ˮ��
3.2g��������ʵ���Ϊ0.2mol�����CԪ�ػ��ϼ۱仯����ת�Ƶ������ʵ�����
��� �⣺��1����֪���٣�CH4��g��+H2O��g��?CO��g��+3H2��g����H=+206.2kJ/mol
�ڣ�CH4��g��+2H2O��g��?CO2��g��+4H2��g����H=+165.0kJ/mol
���ݸ�˹���ɣ���-�ٿɵã�CO��g��+H2O��g��?CO2��g��+H2��g�������ʱ�=�ڵ��ʱ�-�ٵ��ʱ�=-41.2 kJ/mol���ɴ˿ɵ�һ����̼������Ӧ���Ȼ�ѧ����ʽΪ��
CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.2 kJ/mol��
�ʴ�Ϊ��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.2 kJ/mol��
��2�����ɱ������ݿ�֪�������¶ȵ����ߣ��÷�Ӧ��ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ��������¶�ƽ�������ȷ����ƶ���������Ӧ�Ƿ��ȷ�Ӧ�����H��0��
�ʴ�Ϊ������
��B��ĺ�����Ϊ4.0��������Ϊ64%����$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$=4.0��CO2��ƽ��ת����Ϊ64%������ʼʱCO2�����ʵ���Ϊ1mol����NH3�����ʵ���Ϊ4.0mol��CO2�ı仯���ʵ���Ϊ0.64mol����
2NH3��g��+CO2��g��?CO��NH2��2��l��+H2O��l��
��ʼ����mol����4.0 1.0
�仯����mol����1.28 0.64
ƽ������mol����2.72 0.36
��NH3��ƽ��ת���ʣ�����NH3��=$\frac{1.28mol}{4mol}$��100%=32%��
�ʴ�Ϊ��32%��
��3��ȼ�ϵ�ع���ʱ���ڵ�·�������ӴӸ����������ƶ����۲��������ȼ�ϵ��װ��ͼ��֪����ߵ缫Ϊ�������ұߵ缫Ϊ�����������ڸ����Ϸ���������Ӧ�����ɵĶ�����̼�������������Ե������Һ����a�ڷų��������Ƕ�����̼���壻�����������Ϸ�����ԭ��Ӧ���������ӽ������ˮ�������缫��ӦʽΪ��O2+4e-+4H+=2H2O��
3.2g��������ʵ���Ϊ$\frac{3.2g}{16g/mol}$=0.2mol����ת�Ƶ������ʵ���Ϊ0.2mol��8=1.6mol��
�ʴ�Ϊ��CO2��O2+4e-+4H+=2H2O��1.6��
���� ���⿼�黯ѧ��Ӧԭ�����漰��˹���ɡ��Ȼ�ѧ����ʽ����д���¶ȶ�ƽ���ƶ���Ӱ�졢ƽ�ⳣ����ƽ��ת���ʵļ��㡢ԭ��صȣ�ע�⣨3����������Ӧʽ����д��O2+4e-+2H2O=4OH-����Ϊ���Ե������Һ�в��ܴ����������������ӣ�


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ�����Ũ���᳤�ڱ�¶�ڿ�����Ũ�Ⱦ����� | |
| B�� | SO2��ʹƷ����Һ����ˮ����ɫ | |
| C�� | ��ˮ��Ũ�����Ҫʢװ����ɫ�Լ�ƿ�� | |
| D�� | NaCl�����л���NH4Cl��I2�������ü��ȷ���ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢ڢ� | C�� | �٢ڢۢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH=1����Һ�У�NH4+��K+��ClO-��Cl- | |
| B�� | ��SO42-���ڵ���Һ�У�Na+��Mg2+��Ba2+��I- | |
| C�� | ��NO3-���ڵ�ǿ������Һ�У�NH4+��Ba2+��Fe2+��Br- | |
| D�� | ��c��H+��=1.0��10-13mol•L-1����Һ�У�Na+��K+��AlO2-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ں��º�ѹ�����£�aA��g��+bB��g��?2C��g�����Բ�ͬ��Ͷ�ϱȿ�ʼ��Ӧ���ֱ�ﵽƽ��ʱ��C�����������Ͷ�ϱȵĹ�ϵ��ͼ��ʾ��
�ں��º�ѹ�����£�aA��g��+bB��g��?2C��g�����Բ�ͬ��Ͷ�ϱȿ�ʼ��Ӧ���ֱ�ﵽƽ��ʱ��C�����������Ͷ�ϱȵĹ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2+O2$?_{����}^{����}$ 2SO 3��H=-196.6 kJ/mol | |
| B�� | H2��g��+$\frac{1}{2}$O2��g���TH2O�� l ����H=-285.8 kJ/mol | |
| C�� | 2H2�� g ��+O2�� g ���T2H2O �� l ����H=+571.6 kJ/mol | |
| D�� | C��s��+O2�� g ���TCO2��g����H=+393.5 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 7.8g Na2O2�к��е���������ĿΪ0.2 NA | |
| B�� | 0.1mol Fe������ϡHNO3��Ӧ��ת�Ƶ�����Ϊ0.3NA | |
| C�� | 1L 0.1 mol/L Al2��SO4��3��Һ�У�Al3+����ĿΪ0.2 NA | |
| D�� | ��״���£�2.24L CHCl3�ķ�����Ϊ0.1 NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com