
分析 ①将该固体溶于水得无色溶液,则一定不含CuSO4,且Na2CO3、BaCl2不能同时存在;
②向溶液中加入AgNO3溶液,得到白色沉淀,再加稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊,则沉淀为碳酸银,生成气体为二氧化碳,所以一定含Na2CO3,沉淀部分溶解说明还生成AgCl沉淀,则含NaCl,以此来解答.
解答 解:①将该固体溶于水得无色溶液,则一定不含CuSO4,且Na2CO3、BaCl2不能同时存在;②向溶液中加入AgNO3溶液,得到白色沉淀,再加稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊,则沉淀为碳酸银,生成气体为二氧化碳,所以一定含Na2CO3,沉淀部分溶解说明还生成AgCl沉淀,则含NaCl,
(1)根据分析可知,原混合物中一定含Na2CO3、NaCl,一定不存在CuSO4、BaCl2,
故答案为:Na2CO3、NaCl;CuSO4、BaCl2;
(2)可能存在的物质的是KNO3,可利用焰色反应检验是否存在硝酸钾,实验现象为透过蓝色钴玻璃观察呈现紫色,
故答案为:KNO3;焰色反应.
点评 本题考查物质的检验和鉴别,为高频考点,题目难度中等,明确离子共存、离子反应、物质鉴别的现象为解答的关键,体现了化学是以实验为基础的学科特点,侧重分析与实验能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | SO2、O2完全转化为SO3 | B. | SO2、O2、SO3的浓度均不再变化 | ||
| C. | SO2、O2、SO3的浓度一定相等 | D. | 正、逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
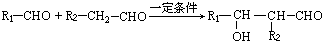
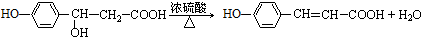
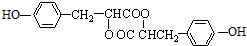 .
.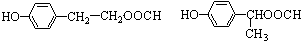 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
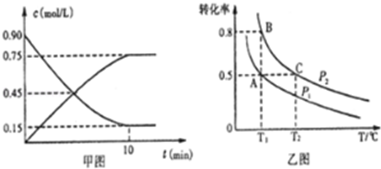
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
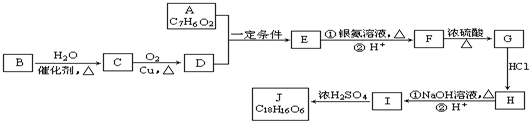
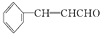 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: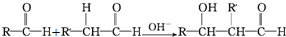
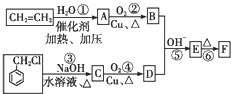
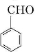 ;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.
;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.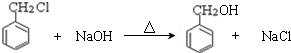 .
.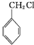 )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).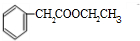
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
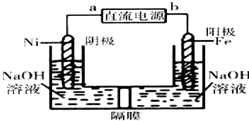 运用化学原理知识研究化学对于人类的生产生活、科研意义重大.
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Pt(Ⅱ)为阳极 | B. | 阳极区酸性增强 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧的电解质储罐中的离子总浓度增大 | |
| B. | 放电时负极的电极反应式为 Zn-2e-═Zn2+ | |
| C. | 充电时电极a为电源的负极 | |
| D. | 阳离子交换膜可阻止 Br2和Zn 直接发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com