
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
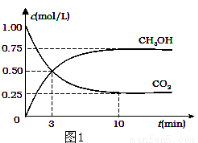
(1)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min);
②氢气平衡时的物质的量浓度为___________;
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2
④当反应达到平衡时, H2的物质的量浓度为c1,然后向容器中再加入1mol CH3OH和1mol H2O,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1______c2的关系(填>、<、=).
(2)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
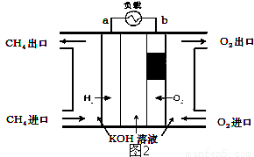
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率___________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:选择题
如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是
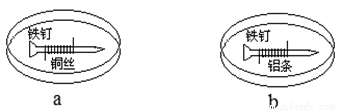
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:选择题
在8NH3+3Cl2=N2+6NH4Cl反应中,氧化剂和还原剂的分子个数之比是( )
A.3∶2 B.3∶8 C.3∶1 D.8∶3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.自发反应在任何条件下都能实现
B.化学反应不一定都有能量变化
C.升高温度,活化分子百分数增大,化学反应速率一定增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期末化学试卷(解析版) 题型:选择题
甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为( )。
A.10∶1 B.1∶10 C.2∶1 D.1∶2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是( )
A. 过滤后的溶液中一定没有S2﹣
B. MnS难溶于水,可溶于MnCl2溶液中
C. 常温时,CuS、PbS、CdS比MnS更难溶
D. 加入MnS后生成CuS的离子方程式是Cu2++S2﹣=CuS↓
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e﹣=LiFePO4; 负极 Li﹣e﹣=Li+ 下列说法中正确的是( )
A. 充电时电池反应为FePO4+Li=LiFePO4
B. 充电时动力电池上标注“+”的电极应与外接电源的负极相连
C. 放电时电池内部Li+向正极移动
D. 放电时,在正极上是Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是()
CH3COO-+H+对于该平衡,下列叙述正确的是()
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:实验题
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(1)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2: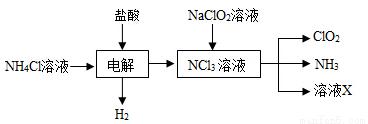
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 C.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
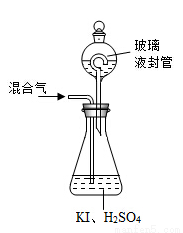
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液
(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g.。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com