
| A. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有碳酸根离子 | |
| B. | 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 | |
| C. | 称量氢氧化钠固体的质量时,将称量物放在烧杯中,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| D. | 向某溶液中滴加NaOH溶液,溶液中出现蓝色沉淀,该溶液中一定含Cu2+ |
分析 A.二氧化碳、二氧化硫都能使澄清石灰水变浑浊;
B.配制一定物质的量浓度溶液时,不能将洗涤量筒的洗涤液倒入烧杯中;
C.用托盘天平称量NaOH时,NaOH具有强烈腐蚀性,所以称量时应该将NaOH放置在小烧杯中,且采用“左物右砝”原则;
D.氢氧化铜为蓝色沉淀.
解答 解:A.二氧化碳、二氧化硫都能使澄清石灰水变浑浊,所以该实验中气体不一定是二氧化碳,且碳酸氢根离子也能和HCl反应生成二氧化碳,则该实验的溶液中不一定含有碳酸根离子,故A错误;
B.配制一定物质的量浓度溶液时,不能将洗涤量筒的洗涤液倒入烧杯中,否则会导致溶液浓度偏高,故B错误;
C.用托盘天平称量NaOH时,NaOH具有强烈腐蚀性,所以称量时应该将NaOH放置在小烧杯中,且采用“左物右砝”原则,所以该实验操作正确,故C正确;
D.氢氧化铜为蓝色沉淀,则加入氢氧化钠生成蓝色沉淀,一定含有铜离子,故D正确;
故选CD.
点评 本题考查化学实验方案评价,为高频考点,侧重考查离子检验、溶液配制、实验操作等知识点,明确实验操作规范性、离子性质是解本题关键,注意排除其它离子的干扰,易错选项是A.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃类分子中的碳原子与其他原子间通过非极性键结合 | |
| B. | 烷烃是饱和的链烃,分子中碳原子不可能在同一平面上 | |
| C. | 甲烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| D. | 烷烃的沸点随碳原子数增加而逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1mol/L的KOH溶液和0.1mol/L的醋酸溶液中,由水电离的OH-浓度 | |
| B. | 常温常压下,0.1mol/L的KOH溶液和0.1mol/L的盐酸溶液中,由水电离的OH-浓度 | |
| C. | 25℃,100mL0.1mol/L醋酸溶液与10 mL 1 mol/L醋酸溶液中的k(HAc) | |
| D. | 100mL0.1mol/L醋酸溶液与10 mL 1 mol/L醋酸溶液中H+的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大 | |
| B. | 25℃时,0.1mol•L-1的HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-3mol•L-1 | |
| C. | 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 25℃时,沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:填空题
I:氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定、易分解、在氯气中能燃烧,与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+= Cu2++Cu。根据以上信息回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是____________。
(2)写出CuH在氯气中燃烧的化学反应方程式________________________。
(3)CuH溶解在稀盐酸中生成的气体是______________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是__________。
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为__________________________。
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是___________。
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是__________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是_________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:推断题
咖啡酸苯乙酯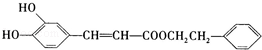 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
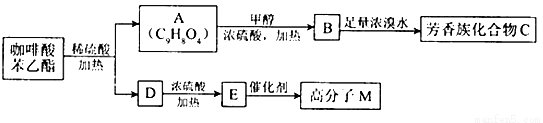
请填写下列空白.
(1)D分子中的官能团是______________;高分子M的结构简式是______________.
(2)写出A→B反应的化学方程式:______________.
(3)B→C发生的反应类型有______________.
(4)A的同分异构体很多种,其中,同时符合下列条件的同分异构体有_________种.
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应.
(5)以下对A具有的性质描述正确的是__________
a.1molA可消耗2molNaOH
b.一定 条件下1molA最多能与1mol氢气加成
条件下1molA最多能与1mol氢气加成
c.能发生银镜反应
d.能发生取代反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和盐酸的反应:CO32ˉ+2H+═CO2↑+H2O | |
| B. | KI溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| C. | 三氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| D. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OHˉ═SiO32ˉ+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com