
【题目】根据所学知识,回答下列问题:
(1)元素周期表1~20号元素中,金属性最强的元素是__________(填元素符号,下同);属于稀有气体的是________________;非金属性最强的元素在周期表中的位置是_______________________。
(2)已知NO2和N2O4之间发生可逆反应:2NO2 (g) (红棕色) ![]() N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________。
N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________。
(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
① 0~3min内,v (NH3)=___________________。
②下列叙述可证明上述反应达到平衡状态的是_________(填序号)。
a. v(H2)= 3 v(N2) b.容器内压强保持不变
c.每消耗1mol N2,同时生成2mol NH3
d. N2、H2和NH3的物质的量浓度不再变化
【答案】 K He、Ne、Ar 第二周期第ⅦA族 气体颜色加深或红棕色加深 存在平衡2NO2![]() N2O4,加热, 平衡发生逆向移动,NO2浓度增大,颜色变深
N2O4,加热, 平衡发生逆向移动,NO2浓度增大,颜色变深 ![]() mol·L-1·min-1 b、d
mol·L-1·min-1 b、d
【解析】(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强,故1~20号元素中,金属性最强的为K,非金属性最强为F,属于稀有气体的有He、Ne、Ar;F位于第二周期第ⅦA族,故答案为:K;He、Ne、Ar; 第二周期第ⅦA族;
(2)平衡2NO2![]() N2O4,该反应正反应为放热反应,温度升高, 平衡发生逆向移动,NO2浓度增大,颜色变深,故答案为:气体颜色加深或红棕色加深;存在平衡2NO2
N2O4,该反应正反应为放热反应,温度升高, 平衡发生逆向移动,NO2浓度增大,颜色变深,故答案为:气体颜色加深或红棕色加深;存在平衡2NO2![]() N2O4,加热, 平衡发生逆向移动,NO2浓度增大,颜色变深;
N2O4,加热, 平衡发生逆向移动,NO2浓度增大,颜色变深;
(3)在2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,即充入的氮气为1.12L,氢气为3.36L,浓度分别为0.025mol/L,0.075mol/L。
① 0~3min内,v(N2)= ![]() =
=![]() =
=![]() mol·L-1·min-1,则v (NH3)= 2v(N2)=
mol·L-1·min-1,则v (NH3)= 2v(N2)= ![]() =2×
=2×![]() mol·L-1·min-1=
mol·L-1·min-1= ![]() mol·L-1·min-1,故答案为:
mol·L-1·min-1,故答案为: ![]() mol·L-1·min-1;
mol·L-1·min-1;
②a. 任何时刻都存在v(H2)= 3 v(N2),不能说明是否为平衡状态,错误;b.该反应属于气体的物质的量发生变化的反应,容器内压强保持不变,能够证明达到平衡状态,正确;c.每消耗1mol N2,同时一定生成2mol NH3 ,不能说明是否为平衡状态,错误;d. N2、H2和NH3的物质的量浓度不再变化,能够证明达到平衡状态,正确;故选bd。


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 蒸馏实验时,应将温度计水银球置于蒸馏烧瓶支管口处
B. 蒸馏实验时,冷水从冷凝管下口入,上口出
C. 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液
D. 萃取实验时,应先后将上下两层液体从下口放出,并用不同烧杯盛放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中每种物质都既有离子键又有共价键的一组是( )。
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、HNO3
C.Ba(OH)2、Na2CO3、Na3PO4
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物己略去)。下列有关物质的推断不正确的是
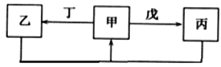
A. 若甲为Al(OH)3,则戊可能为NaOH B. 若甲为Na2CO3,则丁可能为CO2
C. 若甲为N2,则丁可能为O2 D. 若甲为Fe, 则戊可能为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题.
(1)含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是____。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为__________。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 (填字母)
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)3晶体的方法如下:
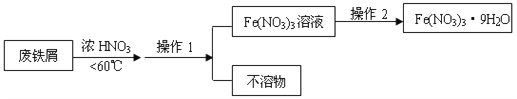
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为_______________。
②磁性氧化铁的化学式为______,试写出Fe2O3与硝酸反应的离子方程式_________________。
③操作1的名称为_____,操作2的步骤为:_____________,过滤,洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A. CH3CH2CH2CH2CH3和CH3CH(CH3)2 B. CH2=C(CH3)2和CH2=CHCH= CH2
C. O2和O3 D. CH3CH2OH和CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是
A. 乙炔通入溴水中 B. 乙烯通入酸性高锰酸钾溶液中
C. 在镍作催化剂的条件下,苯与氢气反应 D. 乙烷与氯气光照下发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com