
【题目】在同温同压下,用惰性电极在U型管中电解下列物质的水溶液,消耗相同的电量时生成气体的体积最大的是(不考虑气体的溶解)
A.HCl溶液 B.CuCl2溶液 C.CuSO4溶液 D.NaOH溶液
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】(1)铜、硝酸银溶液和银组成的原电池装置中,当导线中有0.02mol电子通过时,理论上银片的质量变化了多少?
(2)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) =xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5。求:(1)x的值和反应开始前放入容器中A、B的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
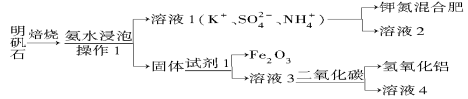
(1)操作1所用到的玻璃仪器的名称是 。
(2)由溶液3制取氢氧化铝的离子方程式为 。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式: 。
(4)请你写出验证溶液1中有NH4+的实验过程: 。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
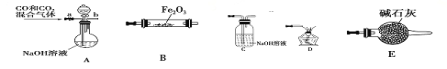
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②在点燃B处的酒精灯前,应进行的操作是____________。
③装置C的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关SO2和CO2的说法正确的是
A.都是非极性分子
B.中心原子都采取sp杂化
C.S原子和C原子都没有孤对电子
D.SO2为V形结构,CO2为直线形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。常见水处理剂还有高铁酸盐及ClO2,请回答下列问题:
(1)FeCl3可以用来刻蚀铜箔制造电路板,写出对应离子方程式 高铁酸盐是一种绿色净水剂,其有效成分是高铁酸根FeO42-。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为 。
(2)ClO2是一种高效、低毒的消毒剂,工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(3)漂白粉在工业中常用氯气通入石灰乳来制备,写出对应化学方程式 。在使用时将漂白粉溶于水配成溶液,放置一段时间即可使用,写出漂白粉工作原理的离子方程式 。氯水也具有漂白性,但是久置氯水因为发生了 反应而失去漂白性。
(4)描述实验室制备氢氧化铁胶体的方法 ,写出对应离子方程式 。
(5)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3
ClO3- + Fe2+ + ( ) = Fe3+ + Cl-+ ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2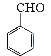 +KOH
+KOH![]()
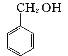 +
+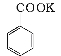 ;
; +HCl
+HCl![]()
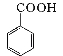 +KCl
+KCl
制备苯甲醇和苯甲酸的主要过程如下:
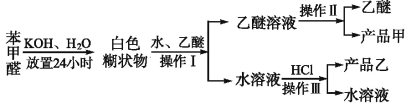
已知:苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是 ;
乙醚溶液中所溶解的主要成分是 (写名称,下同)。
(2)操作Ⅲ的名称是 ;产品乙是 。
(3)现有下图所示的四种装置,进行操作Ⅱ应选择的最合理装置是 (填序号);
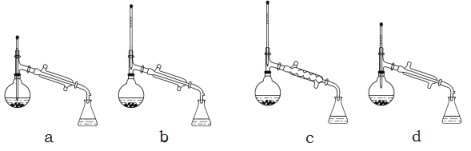
操作中还需要用到的的玻璃仪器是 ;得到的产品甲是在 中(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
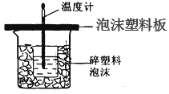
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________;由图可知该装置有不妥之处,应如何改正? 。
(2)实验中改用60 mL0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会______________(填“相等”或 “不相等”),理由是_____________________________。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
(4)将V1ml 1.0mol/L HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)
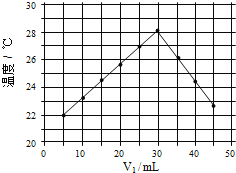
通过分析图像可知,做该实验时环境温度 (填“高于”,“低于”或“等于”)22℃,该NaOH溶液的浓度约为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在在恒容的密闭容器中,能表示反应X (g) + 2Y (g)![]() 2Z (g)一定达到化学平衡状态的是:
2Z (g)一定达到化学平衡状态的是:
①X、Y、Z的物质的量之比为1:2:2
② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化
④ 单位时间内生成n molZ,同时生成2n molY
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com