
 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.分析 (1)同温同压下,气体的物质的量之比等于其气体之比;根据N=nNA计算分子数目;
(2)计算A室中混合气体的平均摩尔质量,同温同压下气体的密度之比等于其摩尔质量之比;
根据总质量、总物质的量列方程计算氢气与氧气物质的量.
解答 解:(1)A、B两室压强与温度相同,气体的物质的量之比等于其气体之比,则A室中气体物质的量为1mol×$\frac{4}{2}$=2mol,含有分子数目为2mol×6.02×1023mol-1=1.204×1024,
故答案为:2mol;1.204×1024;
(2)A室中混合气体的平均摩尔质量为$\frac{34g}{2mol}$=17g/mol,同温同压下气体的密度之比等于其摩尔质量之比,故该混合气体的密度是同温同压条件下氦气密度$\frac{17}{2}$=8.5倍,
设氢气物质的量为xmol、氧气物质的量为ymol,则:
$\left\{\begin{array}{l}{x+y=2}\\{2x+32y=34}\end{array}\right.$
解得x=1、y=1,
则H2与O2的物质的量之比为1mol:1mol=1:1,
故答案为:8.5;1:1.
点评 本题考查阿伏伽德罗定律及其推论,侧重考查学生计算能力,注意根据PV=nRT理解阿伏伽德罗定律及其推论.


科目:高中化学 来源: 题型:选择题
| A. | 由单质A转化为单质B,△H=+119kJ/mol,可知单质A比单质B稳定 | |
| B. | 灼热的碳与CO2反应既是氧化还原反应,又是吸热反应 | |
| C. | 决定化学反应速率的根本因素是参加反应的各物质的结构和性质 | |
| D. | 对于一个可逆反应(△H<0)达到平衡后,升高温度可以使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
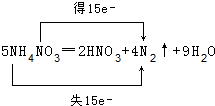
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
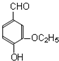 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com