
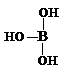 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: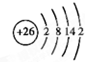 .
. .
. 分析 (1)原子序数最小的第Ⅷ族元素为Fe,核外电子数为29,根据核外电子排布规律书画出Fe原子结构示意图;
(2)3p轨道上有2个未成对电子的元素,其核外电子排布式为1s22s22p62s23p2或1s22s22p62s23p4;
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,处于都是周期ⅥA族,为Se元素;
(4)硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+;
(5)1molSi中含有2molSi-Si,1molSiO2含有4molSi-O键,△H=反应物的键能和-生成物的键能和;
(6)计算氧原子的价层电子数与氧原子的孤对电子对数,判断杂化方式与水合氢离子的空间构型,计二氧化硫中硫原子的价层电子数与氧原子的孤对电子对数,确定其空间结构;
(7)由键能比例关系可知,N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍,键能越小化学键越不稳定,反应越容易进行;
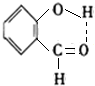
(8)邻羟基苯甲醛分子内羟基H原子与醛基中氧原子之间形成氢键.
解答 解:(1)原子序数最小的第Ⅷ族元素为Fe,核外电子数为29,有4个电子层,根据核外电子排布规律,由里到外各层电子数为2、8、14、2,Fe原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)3p轨道上有2个未成对电子的元素,其核外电子排布式为1s22s22p62s23p2或1s22s22p62s23p4,为Si元素或S元素,故答案为:Si或S;
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,处于都是周期ⅥA族,为Se元素,故答案为:硒;
(4)硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+,硼酸溶于水后溶液显酸性的离子方程式为:B(OH)3+H2O?B(OH)4-+H+,故答案为:B(OH)3+H2O?B(OH)4-+H+;
(5)△H=反应物的键能和-生成物的键能和=2×175KJ/mol+498KJ/mol-4×460KJ/mol=-892KJ/mol,故答案为:-892KJ/mol;
(6)二氧化硫分子是O原子价层电子对2+$\frac{1}{2}$(6-2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+$\frac{1}{2}$(6-2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
水合氢离子中氧原子的价层电子对3+$\frac{1}{2}$(6-1-3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,
故答案为:sp2;sp3;V形;三角锥型;
(7)N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应,
故答案为:N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应;
(8)邻羟基苯甲醛分子内羟基H原子与醛基中氧原子之间形成氢键,分子中氢键如图所示: ,故答案为:
,故答案为: .
.
点评 本题考查结合性质位置关系、核外电子排布、杂化理论与分子构型、键能与分子性质关系、氢键等,题目综合性较大,侧重对基础知识的巩固,难度中等.


科目:高中化学 来源: 题型:填空题
 氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.
氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸溶液,可加快产生氢气的速率 | |
| B. | 用锌片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| C. | 反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
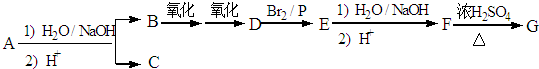
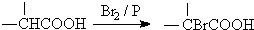
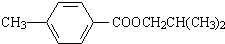 .
.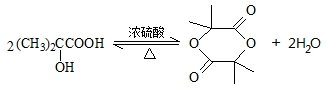 ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型).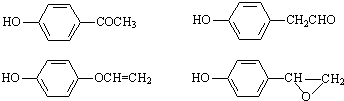 .
.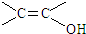 )结构.
)结构.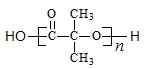 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 电池工作时,H+由正极移向负极 | |
| D. | 电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
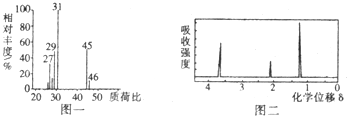
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com