
【题目】实验室利用硫铁矿烧渣(主要含 Fe2O3、SiO2 等)制备碱式硫酸铁[Fea(OH)b (SO4)c]溶液, 并测定其组成。

(1)酸浸时反应的化学方程式为___。
(2)操作 a 的名称为___,X 为___(填化学式)。
(3)加 CaCO3 调节溶液的 pH,其目的是中和溶液中的酸,并使 Fe2(SO4)3 转化为 Fea(OH)b (SO4)c。若溶 液的 pH 偏高,将会导致溶液中铁元素的含量降低,其原因是___(用文字表述)。
(4)为测定碱式硫酸铁的组成,取一定量样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 BaCl2 溶液,得到白色沉淀 1.7475 g。另一份溶液,先将 Fe3+还原为 Fe2+,充分反应后向溶液中滴加 0.02000 mol·L-1 K2 Cr2O7溶液,完全反应时消耗K2 Cr2O7溶液 50.00 mL。求该样品的化学式(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)__________________。(请写出计算过程)
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 过滤 SiO2 溶液的pH偏高,将会导致溶液中的铁元素形成Fe(OH)3沉淀 n(SO42-)=n(BaSO4)=1.7475g÷233g/mol=0.0075mol
由Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知:6Fe2+~Cr2O72-,则碱式硫酸铁中n(Fe3+)=0.02mol/L×0.05Lmol×6=0.006mol
根据电荷守恒3n(Fe3+)=2n(SO42-)+n(OH-),则n(OH-)=0.006mol×3-0.0075mol×2=0.003mol
碱式硫酸铁中n(Fe3+):n(OH-):n(SO42-)=0.006mol:0.003mol:0.0075mol=4:2:5
所以碱式硫酸铁的化学式为Fe4(OH)2(SO4)5
【解析】
硫铁矿烧渣(主要含Fe2O3、SiO2等)和稀硫酸混合,发生反应Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤得滤渣为SiO2,滤液中含有Fe2(SO4)3,加入CaCO3粉末,调节溶液的pH,发生反应生成CaSO4、碱式硫酸铁溶液和CO2,滤渣的成分主要为CaSO4,过滤得滤液,Fe2(SO4)3转化为Fea(OH)b(SO4)c。
(1)酸浸过程中氧化铁和硫酸反应生成硫酸铁和水;
(2)根据分析可知,操作a为过滤,X为SiO2;
(3)若溶液的pH偏高,溶液中的Fe3+和OH-发生离子反应生成Fe(OH)3沉淀使溶液中铁元素的含量降低;
(4)根据碱式硫酸铁[Fea(OH)b(SO4)c]中铁离子和硫酸根离子的守恒,计算出碱式硫酸铁中Fe3+和硫酸根离子的物质的量,再根据电荷守恒计算OH-的物质的量,从而求得该样品的化学式。
(1)通过分析可知,酸浸时反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(2)二氧化硅和硫酸不反应,所以X的成分为SiO2,操作a为过滤,故答案为:过滤,SiO2。
(3)通过分析可知,若溶液的pH偏高,溶液中的Fe3+和OH-发生离子反应生成Fe(OH)3沉淀使溶液中铁元素的含量降低,故答案为:溶液的pH偏高,将会导致溶液中的铁元素形成Fe(OH)3。
(4)n(SO42-)=n(BaSO4)=1.7475g÷233g/mol=0.0075mol
由Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知:6Fe2+~Cr2O72-,则碱式硫酸铁中n(Fe3+)=0.02mol/L×0.05Lmol×6=0.006mol
根据电荷守恒3n(Fe3+)=2n(SO42-)+n(OH-),则n(OH-)=0.006mol×3-0.0075mol×2=0.003mol
碱式硫酸铁中n(Fe3+):n(OH-):n(SO42-)=0.006mol:0.003mol:0.0075mol=4:2:5
所以碱式硫酸铁的化学式为Fe4(OH)2(SO4)5。


科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为___________。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ___________ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为___________。
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为 ___________ 。

(4)写出步骤Ⅳ反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据有关媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为________,其原子半径________镁(填“大于”、“小于”或“等于”);铯的原子核外共有________层电子,最外层电子数为________。
(2)铯与水起剧烈反应,放出________色气体,同时使滴有紫色石蕊试液的溶液显________色,因为______________________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
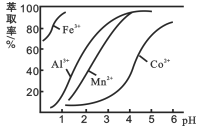
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________;丁装置中稀硫酸的作用是______________。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________管通入 __________气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水):
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________。
(6)根据侯氏制碱原理制备少量NaHCO

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是 ______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com