
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
| x2 |
| (0.01-x)2 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
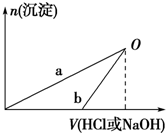 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
| A、①② | B、②④ | C、③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 若反应为2A(g)+B(g)?2C(g),则△H>0,P2>P1 |
B、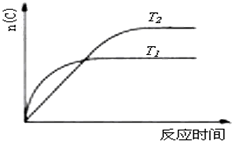 若反应为2A(g)?C(g),则△H>0,T1>T2 |
C、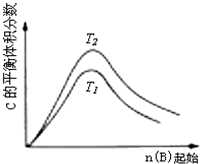 反应为3A(g)+B(g)?2C(g),则△H>0,T2>T1;或△H<0,T2<T1 |
D、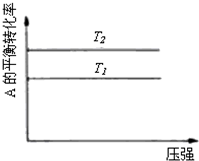 反应为A(g)+B(g)?2C(g),则△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
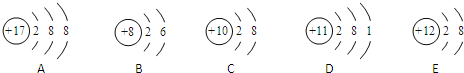
查看答案和解析>>
科目:高中化学 来源: 题型:
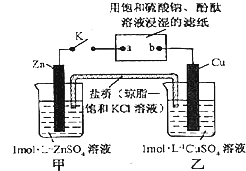
| A、片刻后可观察到滤纸b点变红色 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后甲池中c(SO42-)增大 |
| D、Cu电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的实质是元素化合价发生了变化 |
| B、氧化剂被还原,还原剂被氧化;氧化剂具有氧化性,还原剂具有还原性 |
| C、得到电子的物质被氧化,失去电子的物质被还原 |
| D、氧化还原反应中,氧化剂和还原剂一定是两种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com