
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
分析 (1)依据化学平衡标志是正逆反应速率相同,个组分含量保持不变分析判断;
(2)依据平衡常数分析计算;
解答 解:在一固定体积的密闭容器中,在850℃时发生如下反应:CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)
(1)依据化学平衡标志是正逆反应速率相同,各组分含量保持不变分析判断;
A.反应前后气体体积不变,容器内压强不变不能说明反应达到平衡状态,故A错误;
B、CO的消耗速率等于CO2的生成速率,说明反应正向进行,不能说明反应达到平衡,故B错误;
C、混合气体中CO的体积分数不变,说明反应达到平衡状态,故C正确;
D、(CO2):c(H2)=1:1,是反应生成的浓度比,过程中和平衡状态下都是1:1,不能说明反应达到平衡状态,故D错误;
故答案为:C;
(2)依据化学平衡三段式列式,结合平衡常数计算得到,设消耗一氧化碳浓度为x
CO (g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)
起始量(mol/L) 0.2 0.3 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.2-x 0.3-x x x
K=$\frac{{x}^{2}}{(0.2-x)•(0.3-x)}$=1
x=0.12mol/L
c1=0.2mol/L-0.12mol/L=0.08mol/L;
故答案为:0.08.
点评 本题考查了平衡状态的理解判断,平衡常数计算,注意弱电解质电离平衡常数的计算方法是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
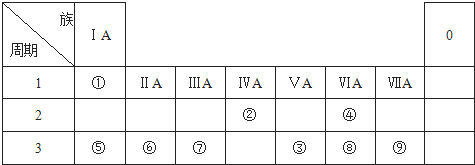
 ;元素⑦的原子结构示意图
;元素⑦的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com