
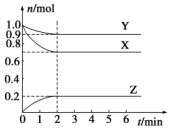
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能/KJ•mol-1 | 436 | 431 | 242 |
分析 根据图知,随着反应进行,X、Y的物质的量减少,Z的物质的量增加,所以X、Y是反应物而Z是生成物;
(1)相同时间内,参加反应的各物质的物质的量的变化量之比等于其计量数之比;
(2)反应开始至2min,v(Z)=$\frac{\frac{△n}{V}}{△t}$;
(3)恒温恒容条件下,气体压强之比等于物质的量之比;根据变化的物质的量及放出的热量,计算1molY完全反应放出的热量即可;
(4)根据所给的反应和表格中的键能,先判断出断键吸收的热量和成键放出的热量,然后用断键吸收的热量减去成键放出的热量既得反应热.
解答 解:根据图知,随着反应进行,X、Y的物质的量减少,Z的物质的量增加,所以X、Y是反应物而Z是生成物;
(1)△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,相同时间内,参加反应的各物质的物质的量的变化量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,则该反应方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应开始至2min,v(Z)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05 mol•L-1•min-1,故答案为:0.05 mol•L-1•min-1;
(3)①开始时气体总物质的量=2.0mol,平衡时气体总物质的量=(0.9+0.7+0.2)mol=1.8mol,恒温恒容条件下,气体压强之比等于物质的量之比,所以反应后压强是反应前的$\frac{1.8mol}{2mol}$=0.9倍,反应中参加反应的Y为0.1mol,放出akJ的热量,则1molY参加反应放出的热量为akJ×$\frac{1mol}{0.1mol}$=10akJ,即△H=-10a kJ•mol-1,
故答案为:0.9;-10a kJ•mol-1;
(4)氢气在氯气中充分燃烧制取HCl气体,则H2(g)+Cl2(g)=2HCl(g)△H=436kJ•mol-1+242 kJ•mol-1-(2×431)kJ•mol-1=-=-183kJ•mol-1,故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-184kJ•mol-1.
点评 本题考查化学平衡计算,侧重考查学生分析计算能力,为高频考点,明确各个物理量之间的关系是解本题关键,注意:(4)题计算化学平衡常数K时不能包含固体,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 如图为原电池装置示意图:
如图为原电池装置示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
,-C15H27为链烃基,则漆酚不应具有的化学性质是( )| A. | 可以跟FeCl3溶液发生显色反应 | B. | 可以使酸性KMnO4溶液褪色 | ||
| C. | 可以跟Na2CO3溶液反应放出CO2 | D. | 可以发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性比钾强 | B. | 最高价氧化物的化学式是SeO3 | ||
| C. | 高价含氧酸的酸性:H2SeO4>H2SO4 | D. | 氢化物稳定性:H2Se>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
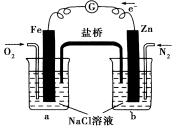
| A. | 烧杯b中发生还原反应 | |
| B. | 烧杯b中发生的反应为2Cl--2e-═Cl2↑ | |
| C. | 烧杯a中发生的反应为2H++2e-═H2↑ | |
| D. | 烧杯a中的溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com