
 .
. .
. .
.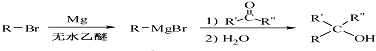
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: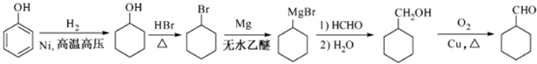 .
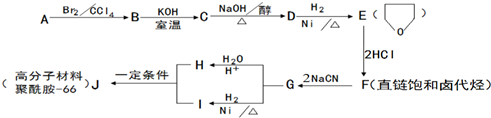
. 分析 1molA和1molH2在一定条件下恰好反应,生成饱和一元醇X,其组成为CnH2n+2O,X中碳元素的质量分数约为65%,则$\frac{12n}{14n+18}$=65%,解得n=4,故X为C4H10O、A为C4H8O.A与溴发生加成反应得B,B发生信息Ⅰ的取代反应生C,则B中有羟基和卤原子,结合E的结构可知A为CH2=CHCH2CH2OH,所以B为CH2BrCHBrCH2CH2OH,C为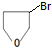 ,D为
,D为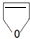 ,E与HCl反应得F,F为直链饱和卤代烃,则F为ClCH2CH2CH2CH2Cl,F与NaCN发生信息Ⅱ中的反应生成G为NCCH2CH2CH2CH2CN,G水解得H为HOOCCH2CH2CH2CH2COOH,G与氢气发生信息Ⅲ中的反应得I为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得J聚酰胺-66(
,E与HCl反应得F,F为直链饱和卤代烃,则F为ClCH2CH2CH2CH2Cl,F与NaCN发生信息Ⅱ中的反应生成G为NCCH2CH2CH2CH2CN,G水解得H为HOOCCH2CH2CH2CH2COOH,G与氢气发生信息Ⅲ中的反应得I为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得J聚酰胺-66( ).
).
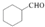
(7)苯酚和氢气加成反应生成环己醇,在加热条件下,环己醇和溴化氢发生取代反应生成1-溴环己烷,1-溴环己烷和镁、无水乙醚反应生成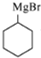 ,
, 和甲醛、水反应生成
和甲醛、水反应生成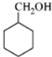 ,
, 在铜作催化剂、加热条件下被氧气氧化生成
在铜作催化剂、加热条件下被氧气氧化生成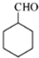 .
.
解答 解:1molA和1molH2在一定条件下恰好反应,生成饱和一元醇X,其组成为CnH2n+2O,X中碳元素的质量分数约为65%,则$\frac{12n}{14n+18}$=65%,解得n=4,故X为C4H10O、A为C4H8O.A与溴发生加成反应得B,B发生信息Ⅰ的取代反应生C,则B中有羟基和卤原子,结合E的结构可知A为CH2=CHCH2CH2OH,所以B为CH2BrCHBrCH2CH2OH,C为 ,D为
,D为 ,E与HCl反应得F,F为直链饱和卤代烃,则F为ClCH2CH2CH2CH2Cl,F与NaCN发生信息Ⅱ中的反应生成G为NCCH2CH2CH2CH2CN,G水解得H为HOOCCH2CH2CH2CH2COOH,G与氢气发生信息Ⅲ中的反应得I为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得J聚酰胺-66(
,E与HCl反应得F,F为直链饱和卤代烃,则F为ClCH2CH2CH2CH2Cl,F与NaCN发生信息Ⅱ中的反应生成G为NCCH2CH2CH2CH2CN,G水解得H为HOOCCH2CH2CH2CH2COOH,G与氢气发生信息Ⅲ中的反应得I为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得J聚酰胺-66( ).
).
(1)由上述分析可知,X的分子式为C4H10O,A为CH2=CHCH2CH2OH,分子中所含官能团为羟基、碳碳双键,
故答案为:C4H10O;羟基、碳碳双键;
(2)B→C的反应类型是取代反应,故答案为:取代反应;
(3)C→D的化学方程式为: ,
,
故答案为: ;
;
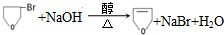
(4)F为ClCH2CH2CH2CH2Cl,F与氢氧化钠的乙醇溶液共热,得到有机产物Y为CH2=CHCH=CH2,
①Y的名称是1,3-丁二烯,故答案为:1,3-丁二烯;
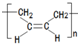
②Y在一定条件下可以发生加聚反应得到以顺式结构为主的顺式聚合物,该顺式聚合物的结构简式为 ,
,
故答案为: ;
;
(5)H和I反应生成J(聚酰胺-66)的化学反应方程式为: ,
,
F为ClCH2CH2CH2CH2Cl,含有官能团为氯原子,先在NaOH水溶液、加热条件下发生水解反应,再用硝酸酸化,最后加热需要溶液,有白色沉淀生成,说明含有氯元素,
故答案为: ;硝酸、硝酸银溶液;
;硝酸、硝酸银溶液;
(6)H为HOOCCH2CH2CH2CH2COOH,H的同分异构体满足下列条件①只含一种官能团,②1mol该物质与足量银氨溶液反应,生成4molAg,说明结构中有两个醛基,符合条件的异构体为 ,共9种.其中核磁共振氢谱有三个峰,面积比为4:4:2为:HCOOCH2CH2CH2CH2OOCH,
,共9种.其中核磁共振氢谱有三个峰,面积比为4:4:2为:HCOOCH2CH2CH2CH2OOCH,
故答案为:HCOOCH2CH2CH2CH2OOCH;
(7)苯酚和氢气加成反应生成环己醇,在加热条件下,环己醇和溴化氢发生取代反应生成1-溴环己烷,1-溴环己烷和镁、无水乙醚反应生成 ,
, 和甲醛、水反应生成
和甲醛、水反应生成 ,
, 在铜作催化剂、加热条件下被氧气氧化生成
在铜作催化剂、加热条件下被氧气氧化生成 ,合成路线流程图为
,合成路线流程图为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,计算确定A的分子式,结合E的结构、给予的信息与进行推断,熟练掌握官能团的性质与转化,较好的考查硝酸分析推理能力、知识迁移运用能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
.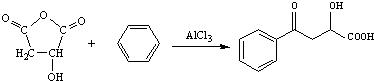 .
.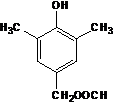 或
或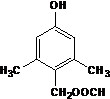 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.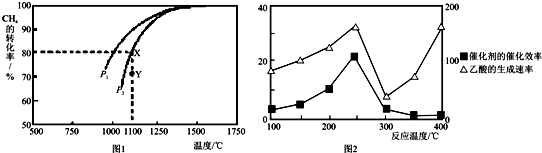
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)、c(SO42-)均增大 | |
| B. | c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2 | |
| C. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)=Ksp(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图: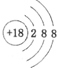 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 电子转移情况: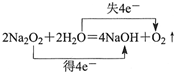 | D. | 氮分子的结构式:N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将1.800g FeC2O4•2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析 曲线(样品质量随温度变化的曲线)如图所示
将1.800g FeC2O4•2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析 曲线(样品质量随温度变化的曲线)如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com