
【题目】用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
(1)Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):________________________。
(2)Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
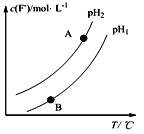
则:适当______温度有利于磷尾矿转化为羟基磷灰石(填“升高”、“降低”);pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F—的速率v(A)____v(B)(填“>”、 “<”、“=”);
(3)已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13,则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=____________。
H2PO4-(aq)+H2O (l)的平衡常数K=____________。
【答案】 > Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 升高 < > 7.52×1011L/mol
H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 升高 < > 7.52×1011L/mol
【解析】(1)Na2HPO4溶液呈碱性,说明HPO42-电离程度小于水解程度,所以c(H2PO4-) >c(PO43-);向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性;(2)根据溶液中c(F-)随溶液的pH和温度(T)的变化曲线可知,升高温度c(F-)增大,反应Ca5(PO4)3F(s) +OH-(aq)
H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性;(2)根据溶液中c(F-)随溶液的pH和温度(T)的变化曲线可知,升高温度c(F-)增大,反应Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-(aq)正向移动,故适当升高温度有利于磷尾矿转化为羟基磷灰石;相同温度下,pH增大,c(OH-)增大,平衡Ca5(PO4)3F(s) +OH-(aq)
Ca5(PO4)3(OH) (s)+F-(aq)正向移动,故适当升高温度有利于磷尾矿转化为羟基磷灰石;相同温度下,pH增大,c(OH-)增大,平衡Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-(aq)正向移动,c(F-)越大,故pH1<pH2;温度越高,化学反应速率越大,A、B两点的温度A大于B,溶液中F—的速率v(A) >v(B);(3)H3PO4(aq)+OH-(aq)
Ca5(PO4)3(OH) (s)+F-(aq)正向移动,c(F-)越大,故pH1<pH2;温度越高,化学反应速率越大,A、B两点的温度A大于B,溶液中F—的速率v(A) >v(B);(3)H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=
H2PO4-(aq)+H2O (l)的平衡常数K=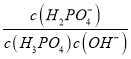 =
=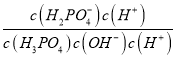 =
=![]() =
=![]() =7.52×1011L/mol。
=7.52×1011L/mol。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法中不正确的是( )
A. 同一横行元素性质基本相同
B. 同一横行元素原子序数从左到右依次递增
C. 同一纵行元素最外层电子数相同
D. 同一纵行元素电子层数自上而下依次递增
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质.)
(1)Ⅰ、把与下面的元素有关性质相符的曲线的标号填入相应括号中:a.ⅡA族元素的最外层电子数 .
b.第三周期元素的最高化合价 .
c.第三周期离子Na+、Mg2+、Al3+、P3﹣、S2﹣、Cl﹣的离子半径 .
d.第二、三周期元素随原子序数递增原子半径的变化 .
(2)Ⅱ、有下列物质:① ![]() C;②
C;② ![]() K;③
K;③ ![]() Ca;④
Ca;④ ![]() C;⑤
C;⑤ ![]() N;⑥
N;⑥ ![]() Ar.其中: a.互为同位素的是 .
Ar.其中: a.互为同位素的是 .
b.质量数相等,但不能互称同位素的是 .
c.中子数相等,但质子数不相等的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)在水溶液中橙红色的Cr2O72--与黄色的CrO42--有下列平衡关系:Cr2O72--+H 2O![]() 2CrO42--+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42--+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈__________色,因为_____________________。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________方向移动(正或逆),溶液颜色将__________(加深或变浅)。
(II)工业上有一种用CO2生产甲醇燃料的方法:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol
某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
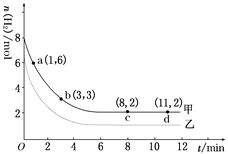
(1)a点正反应速率________逆反应速率(填“>”、“<”或“=”)。
(2)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 一种工业合成氨的简式流程图如下: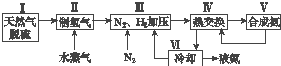
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤Ⅱ中制氢气的原理如下:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4 kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 .
a.升高温度b.增大水蒸气浓度 c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量.若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO的转化率为 .
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: .
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图 . 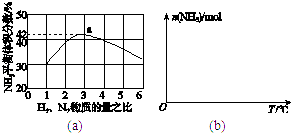
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) . 简述本流程中提高合成氨原料总转化率的方法:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关做焰色反应实验时的注意事项,下列说法不正确的是( )
A. 每次实验中都要先将铂丝灼烧到火焰无色,再蘸取被检验物质
B. 钾的焰色反应要透过蓝色钴玻璃观察
C. 实验时最好选择本身颜色较深的火焰
D. 没有铂丝可用光洁无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~G有如图所示转化关系(部分生成物没有列出).其中A是常见的金属单质,E、F是气体.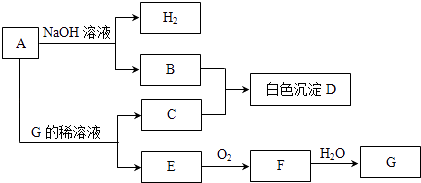
请回答下列问题:
(1)写出下列物质的化学式:A、D、G;
(2)B和C反应生成D的离子方程式为;
(3)A在碱性溶液中和NO3﹣反应时生成B和NH3 , 总反应的离子方程式为;
(4)相同条件下,向500mLE、F的混合气体中通入187.5mLO2 , 所有气体可恰好完全被水吸收生成G,则E和F的体积比为 .
(5)等体积的E、F通入NaOH溶液中可生成盐和水,反应的化学方程式为 . 室温下,0.1mol/L的上述盐溶液pH=8.3,原因是(用离子方程式表示)该溶液中所有离子按浓度由大到小排列的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 合金的熔点一般比各成分金属的熔点高
B. 生铁的硬度比纯铁的硬度大
C. 胶体区别与其他分散系的本质特征是能发生丁达尔现象
D. 因为氯气溶于水可以导电,所以氯水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.“霾尘积聚难见路人”,雾和霾所形成的气溶胶具有丁达尔效应
B.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染
C.“天宫二号”使用的碳纤维是一种新型有机高分子材料
D.丝绸的主要成分是蛋白质,属于天然高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com