
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g) ΔH<0
CH3OCH3(g)+CO2(g) ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 b.加入催化剂
c.缩小容器体积 d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO) b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变 d.混合气体的平均相对分子质量不变
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。

(1)c (2分)
(2)a d (2分) 只选a或d(1分)
(3)①.0.3 (2分); 16/27 (2分); ②.正向(2分)
(4)①.CH3OCH3+16OH- -12e-=2CO32-+11H2O (2分)
②.PbSO4+2H2O-2e-=PbO2+4H++SO42-(2分)
③.288 (2分)
【解析】
试题分析:(1)a、降低了反应速率,错误;b、CO的转化率不变,错误;c、正确;d、反应速率先不变后 减少,错误;
(2)a、正反应速率等于你反应速率时达到化学平衡,正确;b、恒等,不管是否达到平衡,错 误;c、因为体积不变,质量不变,所以密度恒定不变,不管是否达到平衡,错误;d、正 确。
(3)①4*75%/2/5=0.3,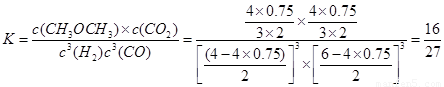
②压强增大,平衡向体积减少的方向移动,即平衡正向移动;
(4)①Pb丝为惰性电极,不参与电极反应,在甲醚燃烧反应中,甲醚中碳元素的化合价升高,被氧化,氧气中氧元素的化合价降低,被还原。在原电池中,负极发生氧化反应,正极发生还原反应,说明通入甲醚的那一极是负极,通入氧气的那一极是正极。甲醚在负极发生氧化反应,氧气在正极发生还原反应。负极(Pb丝),碳的化合价升高到+4价,在KOH溶液中以碳酸根离子的形式存在,所以电极反应为: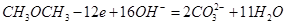 ;
;
②与正极相连的是阳极,Pb在阳极失去电子由+2价氧化为+4价;
③D是硫酸钡被还原为钡单质,所以D电极的质量减少量= 。
。
考点:燃料电池。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| ||
| ||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)
(2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)| 0.03 |
| t |
| 0.03 |
| t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
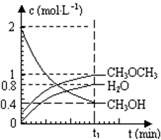 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学键 | C-H | O-H | H-H | C-O | C≡O |
| 键能/kJ.mol-1 | 413 | 463 | 436 | 358 | 1072 |
| 物质 | CH3OH (g) | CH3OCH3 (g) | H2O (g) |
| 起始浓度/mol.l-1 | 2 | 0.2 | 0 |
| 平衡浓度/mol.l-1 | 0.4 | 1 | 0.8 |
| 物质 | CH3OH (g) | CH3OCH3 (g) | H2O (g) |
| 起始浓度/mol.l-1 | 0.4 | 1.2 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com