
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液$\stackrel{+NaOH溶液}{→}$生成蓝色沉淀,说明原溶液中有Cu2+ | |
| C. | 某溶液$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,说明原溶液中有SO42- | |
| D. | 某溶液$\stackrel{+KOH溶液}{→}$生成红褐色沉淀,说明原溶液中有Mg2+ |
分析 A.白色沉淀可能为硫酸银、碳酸银等;
B.蓝色沉淀为氢氧化铜;
C.白色沉淀为AgCl或硫酸钡;
D.红褐色沉淀为氢氧化铁.
解答 解:A.某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液可能有Cl-,或硫酸根离子等,故A错误;
B.某溶液$\stackrel{+NaOH溶液}{→}$生成蓝色沉淀,蓝色沉淀为氢氧化铜,说明原溶液中有Cu2+,故B正确;
C.某溶液$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,说明原溶液中可能有SO42-,或含银离子,但二者不能同时存在,故C错误;
D.某溶液$\stackrel{+KOH溶液}{→}$生成红褐色沉淀,红褐色沉淀为氢氧化铁,说明原溶液中有Fe3+,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.28 |
| A. | 四种溶液中,Na2CO3溶液中水的电离程度最大 | |
| B. | 向氯水中加入少量NaHCO3(s),可以增大氯水中次氯酸的浓度 | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32- | |
| D. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 学校在走道的铁栏杆新刷红色的漆,油漆里的红色颜料的主要成分是Fe2O3 | |
| B. | 用食醋除去茶壶的水垢,是利用了食醋中的醋酸的酸性 | |
| C. | 家用84消毒液,是利用其主要成分次氯酸或次氯酸盐的强氧化性消毒杀菌 | |
| D. | 市面上销售的加碘食盐,可以用滴加淀粉溶液检验碘的存在,现象是变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M g | B. | $\frac{{N}_{A}}{M}$g | C. | $\frac{M}{{M}_{A}}$g | D. | $\frac{M}{2{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 | |
| B. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| C. | 物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度 | |
| D. | 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | Na2O2具有漂白性 | Na2O2可用于潜水呼吸用氧 |
| B | SiO2有导电性 | SiO2可用于制作光导纤维 |
| C | 浓H2SO4有脱水性 | 浓H2SO4可用于干燥Cl2、SO2 |
| D | CO有还原性 | CO可用来冶炼生铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
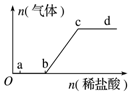 向Na2CO3、NaHCO3混合溶液中逐滴滴入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴滴入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Al3+、H+、SO42-、NO3- | |
| B. | b点对应的溶液中:Ca2+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:F-、NO3-、Fe3+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
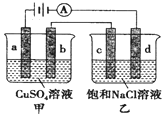
| A. | 向甲中加入适量Cu(OH)2,溶液组成可以恢复 | |
| B. | 电解一段时间,乙溶液中会产生白色沉淀 | |
| C. | 当b极增重3.2g时,d极产生的气体体积为1.12L | |
| D. | 甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com