


科目:高中化学 来源: 题型:
| A、常温下,16gO2和16gO3含的氧原子个数一样多,均为1NA |
| B、0.5NA个一氧化碳分子所占的体积是11.2L |
| C、18gH2O中含电子数为8NA个 |
| D、在2mol?L-1的硝酸镁溶液中含有的硝酸根离子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠与盐酸;氢氧化铜与盐酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液 |
| D、石灰石与硝酸反应;大理石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
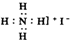
14 6 |
| A、6个 | B、5个 | C、4个 | D、3个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验装置(填字母) | D | ||||||
| 装置中所盛药品(填序号) | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| (i)B2H6 |
| (ii)H2O2/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
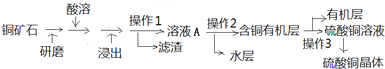
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com